
| A. | NaOH(s) | B. | CH3COONa(s) | C. | FeCl3(s) | D. | NH4Cl |
分析 减缓反应速度,应降低溶液中H+离子的浓度,不影响生成氢气的总量,则所加入物质对溶液中H+离子的总物质的量没有影响,
题目中NaOH与酸中和、NH4Cl水解呈酸性,都引起H+离子的物质的量的变化;
加氯化铁固体,对氢离子浓度无影响且不能形成原电池,加入CH3COONa生成弱酸,H+离子浓度降低,但不影响生成氢气的总量.
解答 解:A、NaOH与酸中和,引起H+离子的物质的量的变化,影响生成氢气的总量,故A错误;
B、加入CH3COONa生成弱酸,H+离子浓度降低,但H+离子的物质的量的不变,则不影响生成氢气的总量,故B正确;
C、加氯化铁固体,过量的Fe能够与氯化铁反应,对氢离子浓度无影响,反应速率不变,故C错误;
D、NH4Cl水解呈酸性,引起H+离子的物质的量增大,影响生成氢气的总量,故D错误;
故选B.
点评 本题考查外界条件对反应速率的影响,做题时注意本题中的两个要求,从物质的性质角度考虑,本题难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX、HZ、HY | B. | HY、HZ、HX | C. | HZ、HY、HX | D. | HX、HY、HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
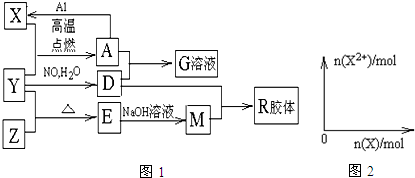
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
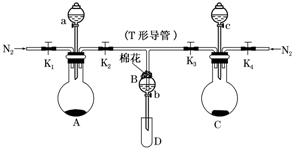 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
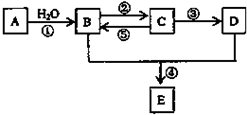 A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.
A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com