
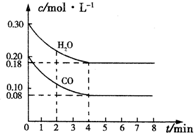
 (1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,
(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,| t/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
分析 (1)由图可知,CO起始浓度为0.2mol/L、H2O的起始浓度为0.3mol/L,850℃时4min达到平衡,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.18 0.12 0.12
根据v=$\frac{△c}{△t}$计算v(CO);平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;CO转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%;
(2)①3min、4min时同种物质的浓度相等,处于平衡状态;
起始浓度与(1)中相同,而(1)中850℃平衡时CO浓度为0.08mol/L,正反应为放热反应,升高温度平衡逆向移动,故该温度下平衡时CO的浓度比原平衡850℃大;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度.
解答 解:(1)由图可知,CO起始浓度为0.2mol/L、H2O的起始浓度为0.3mol/L,850℃时4min达到平衡,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.18 0.12 0.12
v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.18}$=1,CO转化率=$\frac{0.12mol/L}{0.2mol/L}$×100%=60%;
故答案为:0.03mol/(L.min);1;60%;
(2)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,即c1>0.08,
故答案为:平衡,大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选c;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选b,
故答案为:c;b.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、化学平衡图象等,难度中等,(3)中注意分析各物质的浓度变化量关系判断改变条件.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | △H=-484kJ/mol | B. | △H=+484kJ/mol | C. | 吸收484kJ 能量 | D. | 放出484kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3+(甲基正离子)中含有电子数为10NA | |
| B. | 1mol-CH3(甲基)中含有电子数为10NA | |
| C. | 1mol-OH(羟基)与1molOH-所含有电子数相同,均为10NA | |
| D. | 1.8gNH4+中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得电子越多,其氧化性越强 | |
| B. | 金属活动性顺序表中,排在前面的金属阳离子氧化性强于排在后面的金属阳离子 | |
| C. | SO42-中的硫元素化合价是+6价,处于S元素的最高价态,但SO42-不一定具有强氧化性 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为3的溶液,加水稀释10倍后的pH:HCl>H2SO4>CH3COOH | |
| B. | 浓度均为0.1mol•L-1的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 | |
| C. | 碳酸钠溶液中存在:c(OH-)=c(H+)+c(H2CO3)+c(CO32-) | |
| D. | 0.1mol/L Na2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 | |
| B. | 化学反应必定同时遵循质量守恒和能量守恒 | |
| C. | 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 | |
| D. | 已知:C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.4 | B. | 18.4mol/L | C. | 1.84mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com