
分析 氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的,则水电离的氢氧根离子浓度=氢离子浓度=1×10-11mol/L,NaClO溶液中氢离子和氢氧根离子均由水电离,据此分析.
解答 解:室温下pH=13的NaOH溶液中氢离子浓度为1×10-11mol/L,由于氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,所以由水电离的OH-离子的浓度与溶液中氢离子浓度相同;
NaClO溶液中氢离子和氢氧根离子均由水电离,在pH=11的NaClO溶液中,氢离子浓度为1×10-11mol/L,则氢氧根离子浓度为1×10-3 mol/L,溶液中氢氧根离子全部由水电离,所以由水电离的c(OH-)为1×10-3 mol/L;
故答案为:1×10-11mol/L;1×10-3 mol/L.
点评 本题考查了水的电离及其影响,题目难度中等,明确酸碱溶液抑制了水的电离,能够水解的盐促进了水的电离为解答关键,试题培养了学生灵活应用基础知识的能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn-2e-=Zn2+ | B. | Br2+2e-=2Br- | C. | 2Br--2e-=Br2 | D. | Zn2++2e-=Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55℃-60℃反应生成硝基苯 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 | |
| D. | 甲苯与溴蒸气在光照条件下反应主要生成邻溴甲苯和对溴甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
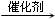
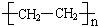 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
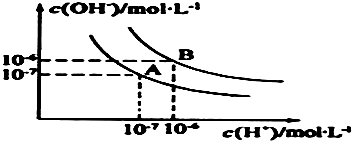 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中碳碳键为单双键交替结构 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯与氢气在一定条件下反应生成环己烷 | |
| D. | 苯可以与溴水反应而使其褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com