
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo=o为499.0kJ·mol-1。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ·mol-1。
CO2(g)+O(g)的△H=_________kJ·mol-1。
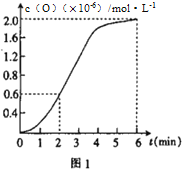
②已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=_________。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
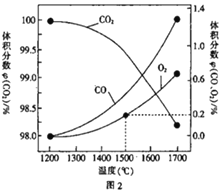
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=_________(计算结果保留1 位小数)。
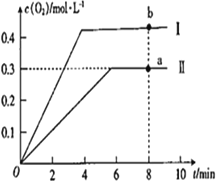
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
【答案】 0.84g -33.5 3×10-7mol·L-1·min-1 AC 3.2×10-8mol·L-1 升温 <
【解析】分析:本题考查与Na2O2有关的计算、反应热的计算、化学反应速率的计算、化学平衡的标志、图像的分析、化学平衡常数的计算。
(1)密闭容器中发生的反应有:2Na2O2+2CO2=2Na2CO3+O2、2CO+O2![]() 2CO2,将两式相加得Na2O2+CO=Na2CO3,固体增加的质量相当于混合气中C对应的CO。
2CO2,将两式相加得Na2O2+CO=Na2CO3,固体增加的质量相当于混合气中C对应的CO。
(2)①应用盖斯定律计算。
②根据图像中数据和化学反应速率的表达式计算υ(O),速率之比等于化学计量数之比。
(3)①可逆反应达到化学平衡的标志是“逆向相等,变量不变”。
②用三段式和图像中关键数据计算化学平衡常数。
③根据“先拐后平”法,结合外界条件对化学反应速率和化学平衡的影响判断改变的条件。
详解:(1)密闭容器中发生的反应有:2Na2O2+2CO2=2Na2CO3+O2、2CO+O2![]() 2CO2,将两式相加得Na2O2+CO=Na2CO3,固体增加的质量相当于混合气中C对应的CO,根据C守恒,混合气中相当于CO为0.03mol,固体质量增加0.03mol
2CO2,将两式相加得Na2O2+CO=Na2CO3,固体增加的质量相当于混合气中C对应的CO,根据C守恒,混合气中相当于CO为0.03mol,固体质量增加0.03mol![]() 28g/mol=0.84g。
28g/mol=0.84g。
(2)①键能EO=O为499.0kJ/mol,则2O(g)=O2(g)ΔH=-499.0kJ/mol(I式);2CO(g)+O2(g)=2CO2(g)ΔH=-566.0kJ/mol(II式),应用盖斯定律,II式![]() -I式
-I式![]() 得,CO(g)+O2(g)
得,CO(g)+O2(g)![]() CO2(g)+O(g)ΔH=(-566.0kJ/mol)
CO2(g)+O(g)ΔH=(-566.0kJ/mol)![]() -(-499.0kJ/mol)
-(-499.0kJ/mol)![]() =-33.5kJ/mol。
=-33.5kJ/mol。
②根据图像υ(O)=![]() =
=![]() =3
=3![]() 10-7mol/(L·min),根据同一反应中不同物质表示的速率之比等于化学计量数之比,则υ(CO2)=υ(O)=3
10-7mol/(L·min),根据同一反应中不同物质表示的速率之比等于化学计量数之比,则υ(CO2)=υ(O)=3![]() 10-7mol/(L·min)。
10-7mol/(L·min)。
(3)①A项,CO的体积分数保持不变能说明反应达到平衡状态;B项,根据质量守恒定律,容器中混合气体的质量始终不变,该容器为恒容容器,混合气体的密度始终不变,混合气体的密度保持不变不能说明反应达到平衡状态;C项,根据质量守恒定律,容器中混合气体的质量始终不变,该反应的正反应为气体分子数增加的反应,建立平衡的过程中,气体分子物质的量增加,混合气体的平均摩尔质量减小,达到平衡时气体分子物质的量不变,混合气体的平均摩尔质量不变,混合气体的平均摩尔质量不变能说明反应达到平衡状态;D项,单位时间内消耗CO的浓度等于生成CO2的浓度仅表示逆反应速率,不能说明反应达到平衡状态;能表明反应达到平衡状态的是AC,答案选AC。
②根据图像1500℃,反应达到平衡时O2的体积分数为0.2%,设平衡时O2浓度为xmol/L,用三段式
2CO2(g)![]() 2CO(g)+O2(g)
2CO(g)+O2(g)
c(起始)(mol/L) 1 0 0
c(转化)(mol/L) 2x 2x x
c(平衡)(mol/L)1-2x 2x x
则![]() =0.2%,解得x=0.002,平衡时CO2、CO、O2的浓度依次为0.996mol/L、0.004mol/L、0.002mol/L,反应的平衡常数K=
=0.2%,解得x=0.002,平衡时CO2、CO、O2的浓度依次为0.996mol/L、0.004mol/L、0.002mol/L,反应的平衡常数K=![]() =
=![]() =3.2
=3.2![]() 10-8mol/L。
10-8mol/L。
③该反应的正反应是气体分子数增大的吸热反应;曲线I相对于曲线II先出现拐点,曲线I的反应速率比曲线II快;曲线I达到平衡时O2的浓度比曲线II平衡时大;即改变的条件既能加快反应速率又能使平衡向正反应方向移动,曲线I 是相对于曲线II改变的条件为升高温度。a点处于曲线II上,b点处于曲线I上,b点温度高于a点,温度越高化学反应速率越快,则υa(CO)![]() υb(CO)。
υb(CO)。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒压、不做功时,反应A+B===C+D在下列哪种情况下,一定能自发进行( )
A. ΔH<0、ΔS<0 B. ΔH>0、ΔS<0 C. ΔH<0、ΔS>0 D. ΔH>0、ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
【答案】(1)氢(2)第2周期ⅣA族(3)Cl
(4) HClO+H2O+SO2=H2SO4+HCl
HClO+H2O+SO2=H2SO4+HCl
【解析】试题分析:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,据此答题.
解:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,
(1)根据上面的分析可知,甲、乙、丙中含有共同元素是氢元素,
故答案为:氢;
(2)B为碳元素,在周期表中第二周期第IVA族,
故答案为:第二周期第IVA族;
(3)上述元素的原子M层有一个未成对p电子的是氯元素,
故答案为:Cl;
(4)丙为次氯酸,它的电子式为![]() ,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
故答案为:![]() ;HClO+H2O+SO2=H2SO4+HCl.
;HClO+H2O+SO2=H2SO4+HCl.
【题型】推断题
【结束】
19
【题目】现有部分前36号元素的性质或原子结构如下表
| 元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
【答案】 ![]() Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO
Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO![]() +2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
+2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
【解析】试题分析:T单质能与水剧烈反应,所得溶液呈弱酸性,所以T是F元素;X元素的L层p电子数比s电子数多2个,X元素是O元素;Y元素是第三周期元素的简单离子中半径最小,Y是Al元素;Z元素L层有三个未成对电子,Z是N元素;
解析:根据以上分析,(1)X为O元素,氧离子核外最外层达到8电子稳定结构,氧离子结构示意图![]() 。
。
(2)Y元素最高价氧化物水化物Al(OH)3,为两性氢氧化物,与盐酸反应生成氯化铝和水,离子方程式为Al(OH)3+3H+===Al3++3H2O;与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-===AlO![]() +2H2O;
+2H2O;
(3)Z是N元素,电子排布式是1s22s22p3; Y是Al元素,电子排布式是1s22s22p63s23p1。
(4)T是F元素,同主族元素从上到下,非金属性减弱,与氯元素相比,非金属性较强的是F;
A.气态氢化物的挥发性不能证明非金属性的强弱,故A错误;
B.单质分子中的键能,不能证明非金属性的强弱,故B错误;
C.非金属性越强,电负性越大,根据两元素的电负性可以判断非金属性,故C正确;
D.根据最高价含氧酸的酸性可以判断非金属性,故D错误;
E.键长越长,越不稳定,
F.单质在自然界中的存在形式,不能判断非金属性,故F错误。
(5)Al为金属元素,具有金属性,其它三种元素为非金属元素,具有较强的非金属性。
点睛:元素非金属性强弱的判断方法:①越易与氢气化合,非金属性越强;②气态氢化物越稳定,非金属性越强;③单质的氧化性越强,非金属性越强;④最高价含氧酸的酸性越强,非金属性越强。
【题型】综合题
【结束】
21
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出了五种元素的相关信息,其中X、Y、Z、W为短周期元素。
元素 | 相关信息 |
X | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
Y | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
Z | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
W | 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
M | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、楼房等 |
根据上述信息填空:
(1)Y元素的基态原子含有几个能层:________,其中第二能层中有哪几个能级:________;画出W的原子结构示意图:________。
(2)Z与X形成的某一化合物能和Z与Y形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式:_______。
(3)某矿藏主要含W、M两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出该生产过程中第一阶段主要反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氮(NCl3)常温下是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3说法中正确的是( )
A. 分子中N—Cl键是非极性键 B. 分子中不存在孤对电子
C. 它的沸点比PCl3沸点低 D. 因N—Cl键键能大,所以NCl3的沸点高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com