(2009?龙岩一模)测定平衡常数对定量认识化学反应具有重要意义.已知:碘单质能与I
-反应成I
3-,并在溶液中建立如下平衡:I
2+I
-?I
3-.通过测平衡体系中c(I
2)、c(I
-)和c(I
3-),就可求得该反应的平衡常数.
I、某同学为测定上述平衡体系中c(I
2),采用如下方法:取V
1 mL平衡混合溶液,用c mol?L
-1的Na
2S
2O
3溶液进行滴定(反应为I
2+2Na
2S
2O
3=2NaI+Na
2S
4O
6),消耗V
2 mL的Na
2S
2O
3溶液.根据V
1、V
2和c可求得c(I
2).
(1)上述滴定时,可采用
淀粉
淀粉
做指示剂,滴定终点的现象是
溶液由蓝色变无色
溶液由蓝色变无色
.
(2)下列对该同学设计方案的分析,正确的是
C
C
(填字母).
A.方案可行.能准确测定溶液中的c(I
2)
B.不可行.因为I
-能与Na
2S
2O
3发生反应
C.不可行.只能测得溶液中c(I
2)与c(I
3-)之和
Ⅱ、科研实践中可采用下述方法来测定该反应的平衡常数(室温条件下进行):
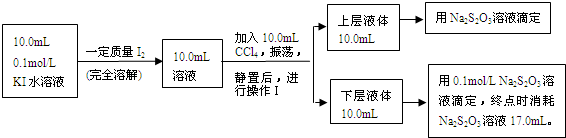
已知:①I
-和I
3-不溶于CCl
4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
是一个常数(用K
d表示,称为分配系数),且室温条件下K
d=85.
回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是
分液漏斗
分液漏斗
(填名称).
(4)下层液体中碘单质的物质的量浓度是
0.085mol/L
0.085mol/L
.
(5)实验测得上层溶液中c(I
3-)=0.049mol?L
-1,结合上述有关数据,计算室温条件下反应I
2+I
-?I
3-的平衡常数K=
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
(用具体数据列出计算式即可).