
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A.1∶1∶1 B.1∶4∶2 C.1∶2∶4 D.1∶3∶2
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】如图表示反应A(g)+B(g)nC(g)+Q (Q>0),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是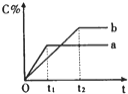
A. 反应由逆反应开始
B. 若n=2,其它条件相同,a比b的压强大
C. 若其它条件相同,a比b的温度高
D. a表示有催化剂,b表示无催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0)
2SO3(g)+Q (Q>0)
(1)写出该反应的化学平衡常数表达式K=_________.
(2)降低温度,该反应K值_________,二氧化硫转化率_________,正反应速度_________.(以上均填增大、减小或不变)
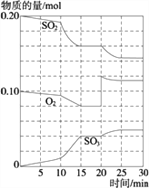
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_________.
据图判断,反应进行至20 min时,曲线发生变化的原因_____________________(用文字表达);10 min到15 min的曲线变化的原因可能是_________(填写编号).
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某烷烃的键线式为![]() ,
,
①该烷烃分子式为_____。
②若该烷烃是由烯烃和 1molH2加成得到的,则原烯烃的结构有_____种。
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有______种。(此小题不包括立体异构)
(2)沧州铁狮酒的主要成分是我们学习的有机物——乙醇,请写出该有机物官能团的名称______,该官能团的电子式______。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物(填字母)
①能氧化成醛的是_______ ②不能发生消去反应形成烯的是_________③能氧化成酮的是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作或事故处理方法正确的是( )
A. 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿内称量
B. 实验室制取氧气时,先加入药品,然后再检查装置的气密性
C. 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀碳酸氢钠溶液
D. 粗盐提纯时,将制得的晶体转移到新制过滤器中用大量水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y(g)3Z(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )
A.v(正)减小,v(逆)增大
B.v(正)增大,v(逆)减小
C.v(正)、v(逆)都减小
D.v(正)、v(逆)都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com