
(1)25℃时,浓度为0.1 mol·L-1的6种溶液:①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液pH由小到大的顺序为__________________(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh= mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈 (填“酸性”,“中性”或“碱性”) ,请写出溶液中离子浓度间的一个等式: 。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,
则溶液中c(CH3COO-) + c(CH3COOH)= ,m与n的大小关系是m n(填“ >”“=”或“<”)。
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,则NH3·H2O的电离常数Ka= 。
(1)①②⑥⑤④③
(2)5.9×10-10
(3)酸性 c(Na+) + c(H+) = c(CH3COO-) + c(OH-)。
(4)m/2 mol/L >
(5)1.7×10-5mol/L
解析试题分析:(1)①HCl是一元强酸, ②CH3OOH是一元弱酸, ③Ba(OH)2是二元强碱,④Na 2CO3是强碱弱酸盐,⑤KCl是强酸强碱盐,⑥NH4Cl是强酸弱碱盐。酸性:强酸大于弱酸大于强酸弱碱盐;碱性:碱的大于强碱弱酸盐的。所以这几种溶液pH由小到大的顺序为①②⑥⑤④③.
(2)KHAc CH3COO-+H+,
CH3COO-+H+,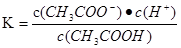 ,该温度下CH3COONa的水解平衡为CH3COO-+H2O
,该温度下CH3COONa的水解平衡为CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
水解平衡常数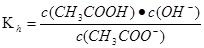

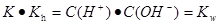
所以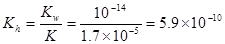 。(3)25℃时,pH=3的醋酸,c(H+)=10-3mol/L, pH=11的氢氧化钠溶液,c(H+)=10-11mol/L,则c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L.两种溶液中的离子浓度相等。当等体积混合后,电离的部分巧合完全中和。但由于醋酸为弱酸。还有大量为电离的醋酸分子存在,会继续电离产生H+和CH3COO-。所以溶液呈酸性。在溶液中存在电荷守恒。c(Na+) + c(H+) = c(CH3COO-) + c(OH-)。(4)由于溶液为等体积混合,所以溶液中c(CH3COO-) + c(CH3COOH)=m/2mol/L。因为酸是弱酸,碱是强碱,若等物质的量混合,这恰好生成CH3COONa。溶液由于CH3COO-的水解二显碱性。为了使溶液显中性,酸必须稍微过量一些,来抵消醋酸根离子水解的碱性。所以m与n的大小关系是m>n. (5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,说明醋酸与一水合氨的强弱程度相同。也就是电离程度相等。由于醋酸的电离平衡常数为Ka=1.7×10-5mol/L所以NH3·H2O的电离常数Ka=1.7×10-5mol/L。
。(3)25℃时,pH=3的醋酸,c(H+)=10-3mol/L, pH=11的氢氧化钠溶液,c(H+)=10-11mol/L,则c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L.两种溶液中的离子浓度相等。当等体积混合后,电离的部分巧合完全中和。但由于醋酸为弱酸。还有大量为电离的醋酸分子存在,会继续电离产生H+和CH3COO-。所以溶液呈酸性。在溶液中存在电荷守恒。c(Na+) + c(H+) = c(CH3COO-) + c(OH-)。(4)由于溶液为等体积混合,所以溶液中c(CH3COO-) + c(CH3COOH)=m/2mol/L。因为酸是弱酸,碱是强碱,若等物质的量混合,这恰好生成CH3COONa。溶液由于CH3COO-的水解二显碱性。为了使溶液显中性,酸必须稍微过量一些,来抵消醋酸根离子水解的碱性。所以m与n的大小关系是m>n. (5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,说明醋酸与一水合氨的强弱程度相同。也就是电离程度相等。由于醋酸的电离平衡常数为Ka=1.7×10-5mol/L所以NH3·H2O的电离常数Ka=1.7×10-5mol/L。
考点:考查离子浓度的大小比较、电离平衡常数与盐的水解平衡常数的关系、溶液的酸碱性等知识。


科目:高中化学 来源: 题型:填空题
如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。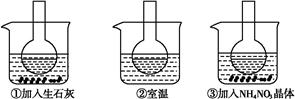
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
| A.水解反应为放热反应 | B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 | D.NH4NO3溶于水时吸收热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是 。
(2)向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液
②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是_______________ ;
(5)某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”,“>”,或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为 。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是 (填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
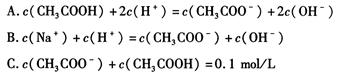
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度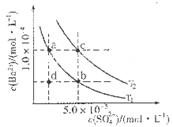
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如下图所示,已知CaSO4的Ksp=9.1×10-6,CaCO3的Ksp=2.8×10-9,请回答: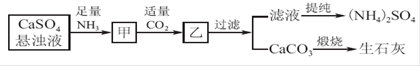
(1)向甲中通入过量CO2_____(填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_______________________________________________________________。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是________(填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松,易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为____________________________________。
②请分析CaSO4转化为CaCO3的原理:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,
③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com