
【题目】现有室温下浓度均为 1×10-3 mol·L-1 的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH 溶液。回答下列问题:
(1)上述 6 种溶液中,水电离出的 c(H+)最大的是_____(填序号,下同),最小的是_____。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③_______⑥(填“>”“<”或 “=”)。
(3)将等体积的①、⑤混合,则溶液的 pH__7(填“>”“<”或“=”),用离子方程式说 明其原因:_______。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____,最终产生 H2 总量的关系为_____(用“>”或“=”连接)。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的 pH 大小关系为①_______③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤______⑥
【答案】④ ② > < ![]() +H2O
+H2O![]() NH3·H2O+H+ ②①③ ②>①=③ < <
NH3·H2O+H+ ②①③ ②>①=③ < <
【解析】
(1)酸或碱的电离抑制水的电离,盐类的水解促进水的电离;
(2)强碱弱酸盐溶液显碱性,据此分析;
(3)一水合氨为弱碱,铵盐水溶液中存在铵根的水解;
(4)氢离子浓度越大,反应速率越快;氢离子的物质的量越多,生成的氢气越多;
(6)升高温度促进一水合氨的电离,但依然不能完全电离,且会使氨水挥发出氨气。
(1)盐酸、硫酸、醋酸、NaOH、一水合氨的电离抑制水的电离,氯化铵溶液中铵根的水解促进水的电离,所以水电离出的c(H+)最大的是④,浓度均相等,但硫酸为二元酸,所以硫酸电离出的氢离子更多,对水的电离抑制作用更大,所以水电离出的c(H+)最小的是②;
(2)醋酸为弱酸,若二者等体积混合得到的溶液溶质为醋酸钠,醋酸钠溶液显碱性,所以若要二者混合液显中性,酸要多一些,即消耗的体积③>⑥;
(3)将等体积的①、⑤混合得到的溶液溶质为氯化铵,铵根水解:![]() +H2O
+H2O![]() NH3·H2O+H+,会使溶液显酸性,所以pH<7;
NH3·H2O+H+,会使溶液显酸性,所以pH<7;
(4)因三种溶液初始浓度相同,而硫酸为二元酸,所以硫酸中氢离子浓度最大,反应速率最快,醋酸为弱酸,相同浓度下溶液中氢离子浓度小于盐酸,所以醋酸反应速率最慢,所以反应的初始速率由快到慢的顺序为②①③;硫酸为二元酸,所含氢离子的物质的量最大,所以生成的氢气最多,醋酸和盐酸所含氢离子的物质的量相同,所以产生的氢气相同,最终产生 H2 总量的关系为②>①=③;
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,混合后,溶液可以看成“分别向醋酸中加入等体积的①氯化钠和③醋酸钠”,由于氯化钠溶液显中性,而醋酸钠溶液显碱性,所以充分混合后,混合液的 pH 大小关系为①<③;
(6)等体积等浓度的⑤、⑥溶液,由于一水合氨不完全电离,所以pH⑤<⑥;加热促进一水合氨电离,但其依然不能完全电离,所以pH值依然<⑥,且由于氨水加热后挥发出氨气,氨水浓度减小,溶液的pH大小关系为⑤<⑥。


科目:高中化学 来源: 题型:
【题目】向 Na2CO3 溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).
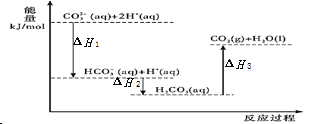
A.△H1 >△H2 ; △H2<△H3
B.反应 ![]() (aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
(aq)+H+(aq)= CO2 (g)+H2O(l)为放热反应
C.![]() (aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3 变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
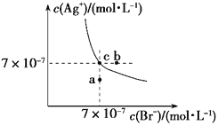
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含 Cr2O72-废水( pH 约为 6)和淡化食盐水,其装置示意图如图所示。图中 D 和 E 为阳离子交换膜或阴离子交换膜,Z 为 待淡化食盐水。已知 Cr3+ 完全沉淀所需的 pH 为 5.6。下列说法不正确的是
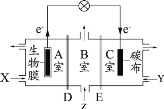
A.C室的电极反应式为 ![]() +6e+8H+=2Cr(OH)3 ↓ + H2O
+6e+8H+=2Cr(OH)3 ↓ + H2O
B.X为有机物污水,Y为含![]() 废水
废水
C.理论上处理 1mol![]() 废水的同时可脱除 6mol的NaCl
废水的同时可脱除 6mol的NaCl
D.E为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______(填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________;负极反应是____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) ![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____(填写序号);其中②中氯离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种烷烃和一种烯烃组成的混合气体共10 g,混合气体的密度是相同状况下氢气密度的12.5倍,该混合气体通过Br2水时,Br2水的质量增加8.4 g,则组成该混合气体的可能是( )
A.甲烷、乙烯B.丙烷、乙烯C.乙烷、丙烯D.甲烷、丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是( )
A.C的非金属性强于Si,CH4的沸点高于SiH4
B.![]() 与
与![]() 得电子能力相同
得电子能力相同
C.短周期元素中原子半径最大的为Na
D.同族元素的原子化学性质相似,同族元素原子间可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
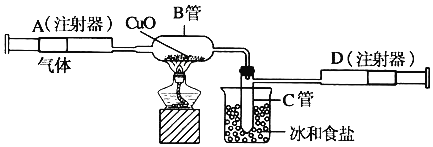
在注射器A中装有260毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重![]() 克,实验后B管重
克,实验后B管重![]() 克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由______和______元素组成的。
(2)若260毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是26000毫升,则X的摩尔质量是______克/摩尔。
(3)通过计算,确定X的分子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com