
请分别选用一种试剂(写名称)除去下列物质中的杂质,并写出相应的化学方程式。
| | 物质 | 杂质 | 所选试剂名称 | 化学方程式 |
| ① | NaHCO3溶液 | Na2CO3 | | |
| ② | Mg粉 | Al 粉 | | |
| ③ | FeCl3溶液 | FeCl2 | | |
(名称1分,方程式2分共9分) 物质 杂质 所选试剂名称 化学方程式 ① NaHCO3溶液 Na2CO3 二氧化碳 Na2CO3+CO2+H2O=2NaHCO3 ② Mg粉 Al 粉 氢氧化钠溶液 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ③ FeCl3溶液 FeCl2 氯气或氯水 Cl2+2FeCl2=3FeCl3
解析试题分析:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则,据此可以判断。
①碳酸钠能吸收CO2转化为碳酸氢钠,因此要除去碳酸氢钠溶液中的碳酸钠,可以选择的试剂是CO2,有关反应的化学方程式为Na2CO3+CO2+H2O=2NaHCO3;
②镁和铝都是活泼的金属,都易与酸反应。但铝还能和氢氧化钠溶液反应,而镁不能,所以要除去镁粉中的铝粉可选择的试剂是氢氧化钠溶液,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③氯化亚铁具有还原性,易被氧化,因此要除去氯化铁溶液中的氯化亚铁可选择的试剂是氯气或新制氯水,反应的化学方程式为Cl2+2FeCl2=3FeCl3。
考点:考查物质除杂的有关判断


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
将Fe、Cu加入含Fe2+、Fe3+和Cu2+的溶液中充分反应,如Fe有剩余,则反应器中金属元素的存在形式只能是
| A.Cu、Fe3+、Fe | B.Fe2+、Fe3+、Fe |
| C.Cu、Cu2+、Fe | D.Cu、Fe2+、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于Na2CO3和NaHCO3性质的说法,正确的是
| A.热稳定性:NaHCO3 > Na2CO3 |
| B.与澄清石灰水反应:Na2CO3、NaHCO3溶液中均有沉淀生成 |
| C.相同温度时,在水中的溶解性:NaHCO3 > Na2CO3 |
| D.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是
| A.9.2g | B.10.6g | C.6.2g | D.4.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol?L-1和1.5 mol?L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质的量为0.10 mol的镁条在足量的、且只含有CO2和O2混合气体的容器中充分燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
| A.3.2g | B.4.2g | C.4.4g | D.4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是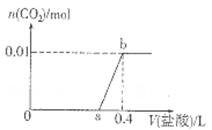
| A.在0-a范围内,只发生中和反应 |
| B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑ |
| C.a=0.3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
| A.Al | B.Al(OH)3 | C.AlCl3 | D.Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com