
(1)依据第2周 期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
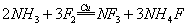
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚(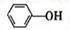 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子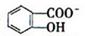 能形成分子内氢键。据此判断,相同
能形成分子内氢键。据此判断,相同 温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
【知识点】化学键、晶体结构、电子排布式的书写、杂化轨道、分子的空间构型以及电离
常数等知识。
【答案】

【解析】(1)同周期元素第一电离能从左到右有增大的趋势。由于N 原子为1S22S22P3 达
到半满结构,相对较稳定,所以第一电离能会有所增大,O 原子为1S2 2S2 2P4 ,2P 轨道有一堆成堆电子,相对于N 原子的半满结构,第一电离能会略小于N,即C<O<N;
(2)①Cu 属于金属晶 体,NH3、F2、NF3 属于分子晶体,NH4F 属于离子晶体。
体,NH3、F2、NF3 属于分子晶体,NH4F 属于离子晶体。
②29Cu 的基态核外电子排布式为1s22s22p63s23p63d104s1( 这样排列保证了3d轨道的全充满和4s轨道的半充满)或者[Ar]3d104s1。
(3)①H2O 分子中的O 原子与(H2O)2·BF3分子中的H 原子之间存在氢键,(H2O)2·BF3分子中H2O分子和BF3分子之间存在配位键,H2O 分 子内的O 原子与H 原子之间存在共价键,Q 分子之间存在分子间作用力;
子内的O 原子与H 原子之间存在共价键,Q 分子之间存在分子间作用力;
②水合氢离子中O 原子有一对孤对 电子,会排斥三个氢原子(和氨分子类似),即空间构型为三角锥形
电子,会排斥三个氢原子(和氨分子类似),即空间构型为三角锥形
(4) 能形成分子内氢键, 致使H+ 更难电离, 而苯酚属于弱酸, 就能电离出H+ , 即
Ka2(水杨酸)<Ka(苯酚)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,其上标有:①温度 ②浓度 ③容积 ④压强 ⑤刻度线 ⑥酸式或碱式这六项中的
A.②④⑥ B.①③⑤ C.①②④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期原子序数依次增大的元素A,B,C,D中,
A和B 的价电子层中未成对电子均只有1个,平且A-和B+
的价电子层中未成对电子均只有1个,平且A-和B+
 的电子相差为8;与B位于同一周期的C和D,它们价
的电子相差为8;与B位于同一周期的C和D,它们价
电子层中的未成对电子数分别为4和2,且原子序数
相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,
电负性最大的是________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍在电池、合金、催化剂等方面应用广泛。
(1)下列关于金属及金属键的说法正确的是________。
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________________ _________________________________________________。
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(4)甲醛(H2C===O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为________,甲醇分子内的O-C-H键角________(填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
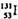 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中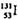 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关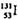 的叙述中错误的是
的叙述中错误的是
A. 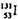 的化学性质与
的化学性质与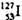 相同 B.
相同 B. 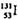 的原子序数为53
的原子序数为53
C. 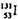 的原子核外电子数为78 D.
的原子核外电子数为78 D. 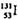 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A. 分子晶体中的每个分子内一定含有共价键
B. 原子晶体中的相邻原子间只存在非极性共价键
C. 离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com