
 如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )
如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )| A. | M分子的所有原子共面 | |
| B. | 0.1mol/L的N溶液中H+的物质的量浓度为0.1mol/L | |
| C. | L 存在同分异构体 | |
| D. | M、L都是烃类 |
分析 小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构,由图可知,发生CH2=CH2+HF→CH3CH2F,M为乙烯,N为HF,L为CH3CH2F,以此来解答.
解答 解:小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构,由图可知,发生CH2=CH2+HF→CH3CH2F,
A.M为乙烯,含碳碳双键,为平面结构,M分子的所有原子共面,故A正确;
B.N为HF,为弱酸,存在电离平衡,则0.1mol/L的N溶液中H+的物质的量浓度小于0.1mol/L,故B错误;
C.由乙烷中6个H相同可知,L为CH3CH2F,只有一种结构,不存在同分异构体,故C错误;
D.M为烃类,L为卤代烃,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的比例模型、结构、官能团为解答的关键,侧重分析与应用能力的考查,注意物质的推断,题目难度不大.


科目:高中化学 来源: 题型:解答题
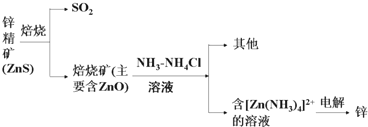
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| B. | 淀粉、纤维素水解的最终产物均为葡萄糖 | |
| C. | 由甲烷的氯代物有4种,可推知乙烷的氯代物有6种 | |
| D. | 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH>Mg(OH)2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3<PH3<SiH4 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的气态氢化物的水溶液显酸性 | |
| B. | X的原子半径小于Y | |
| C. | Z的最外层电子数比Y多 | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 实验操作 | 实验现象 |
| a | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol•L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生 试管B中出现大量气泡 |
| b | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 两支试管中都未见明显气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性较强的溶液中,金属主要发生析氢腐蚀 | |
| B. | 钢铁制品吸氧腐蚀时正极反应:O2+2H2O+4e-═4OH- | |
| C. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接 | |
| D. | 在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com