解:(1)需氢氧化钠的质量为m=0.5L×0.1mol?L
-1×40g/mol=2.0g.
氢氧化钠有腐蚀性,易潮解,应放在小烧杯内迅速称量.
故答案为:2.0;小烧杯.
(2)配制500ml,0.1mol/LNaOH溶液,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以需要的仪器有托盘天平、烧杯、玻璃棒、500ml的容量瓶、胶头滴管、药匙.不需要D1000ml的容量瓶、E碱式滴定管
故选:DE
(3)由(2)中分析可知,还需要的仪器为500ml的容量瓶.
故答案为:500ml的容量瓶.
(4)定容时应往容量瓶中加水至液面离容量瓶颈刻度下1-2cm时,改用胶头滴管滴加蒸馏水,滴加至液面与刻度线平视相切.
故答案为:往容量瓶中加水至液面离容量瓶颈刻度下1-2cm时,改用胶头滴管滴加蒸馏水,滴加至液面与刻度线平视相切.
(5)A.称量NaOH固体时,砝码和物质的位置对调,如未使用游码,对氢氧化钠的质量无影响,对所配溶液浓度无影响;
若使用游码,氢氧化钠的实际质量减小,所配溶液的浓度偏低.
B.向容量瓶中转移时,不慎洒出,导致移入容量瓶内氢氧化钠的质量减小,所配溶液浓度偏低.
C.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高;
D.定容时,仰视容量瓶刻度线,使溶液的体积偏大,所以溶液浓度偏低;
E.定容时,加水超过刻度线,使溶液的体积偏大,所配溶液浓度偏低,溶液是均匀的,再用胶头滴管吸出多余的部分,
剩余溶液与所配溶液浓度相同.
故选:C
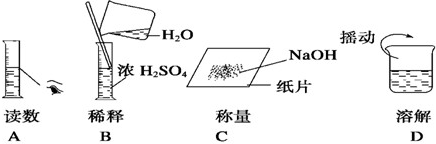
(6)A、量取液体读数,视线应平视凹液面最低处.故A有1处错误;
B、不能再量筒内稀释或溶解,浓硫酸稀释应将浓硫酸加入水中,边搅拌,故B有2处错误;
C、氢氧化钠应放在小烧杯内称量,故C有1处错误;
D、溶解应用玻璃棒搅拌,故C有1处错误;
故选:B
分析:(1)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量.
腐蚀性易潮解的药品应放在玻璃器皿内,迅速称量.
(2)(3)据配制溶液的步骤操作选择所用仪器;
(4)定容操作为往容量瓶中加水至液面离容量瓶颈刻度下1-2cm时,改用胶头滴管滴加蒸馏水,滴加至液面与刻度线平视相切.
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
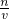
分析判断.
(6)根据基本操作的具体的步骤判断.
点评:考查溶液的配制,难度不大,关键清楚溶液配制的原理,通过c=
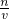
可以加深理解.

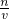 分析判断.
分析判断.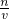 可以加深理解.
可以加深理解. 


