尿素(H
2NCONH
2)是一种非常重要的高氮化肥.在工农业生产中有着非常重要的地位.工业上合成尿素的反应如下:
2NH
3(g)+CO
2(g)?H
2O(g)+H
2NCONH(g)△H=-103.7kJ.mol
(1)在温度70~95℃时,工业尾气中的NO、NO
2可以尿素溶液吸收,将其转化为N
2①尿素与NO、NO
2三者等物质的量反应,化学方程式为
.
②已知:N
2(g)+O
2(g)═2NO(g)△H=180.6kJ?mol
-1N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-12H
2(g)+O
2(g)═2H
2O(g)△H=483.6kJ?mol
-1则4NO(g)+4NH
3(g)+O
2(g)═4N
2(g)+6H
2O(g)△H=
.
(2)某实验小组模拟工业上合成尿素的条件.在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L,的密闭容器中经20miri达到平衡,各物质浓度的变化曲线如图所示.
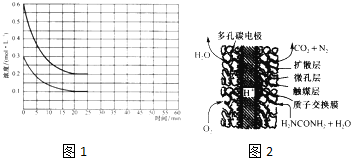
①在上述条件下,从反应开始至20min时.二氧化碳的平均反应速率为
.
②该反应的平衡常数K=
;若升高体系的温度,容器中NH
3的体积分数将
(填“增加”、“减小”或“不变”).
③若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v
正
v
逆(填“>”“=”或“<”),判断理由
.
(3)尿素燃料电池结构如图所示.其工作时负极电极反应式可表示为
.




 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案