
 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
研究化肥的合成、废水的处理等有现实的重要意义。
Ⅰ.尿素是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
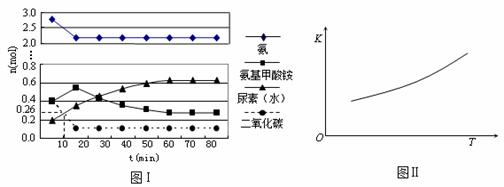 |
① 已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
② 反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
③ 第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 0
(填“>”“<”或“=”)
Ⅱ.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
(3)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,
c(AsO43-)最大是 mol·L-1。
(4)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
(5)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
① 将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
② Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为
该反应在石英真空管中进行,如下图所示:
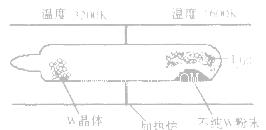
①反应(I)的平衡常数表达式K=_______,若K=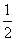 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的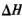 ____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等.
(2)25℃时,NaHSO3的水解平衡常数=1.0×10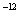 mol
mol ,则该温度下
,则该温度下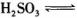
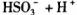 的电离常数
的电离常数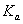 =____mol
=____mol ,若向H2SO3溶液中加入少量的I2,则溶液中
,若向H2SO3溶液中加入少量的I2,则溶液中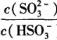 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:

当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列溶质配制一种混合溶液,已知溶液中C(K+)=C(Cl-)=1/2C(Na+)=C(SO42-),则其溶质可能是( )
A.KCl、Na2SO4 B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4 D.KCl、K2SO4、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
⑴下列有关制备银镜过程的说法正确的是 。
a. 边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的pH增大
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② | 若银镜消失,假设②成立。 若银镜不消失,假设②不成立。 |
【思考与交流】
⑷甲同学验证了假设1成立,若乙同学验证了假设2成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有五种短周期元素的性质、用途或原子结构信息如下表:

请根据表中信息回答下列问题:
(1)Q最简单的气态氢化物分子的空间构型为________。
(2)R单质与X单质在雷电条件下反应产物为________化合物(填“共价”或“离子”)。
(3)写出R与Z组成仅含离子键的化合物的化学式:______________。
(4)工业上用电解Y与Z形成化合物的水溶液制取Y单质,写出该反应的离子方程式:_______________。
(5)在1.01×105Pa、298 K时,1.4 g QR气体在1.6 g R2气体中完全燃烧,生成QR2气体时放出14.15 kJ热量,写出QR的燃烧热化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
则下列有关的判断正确的是 ( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C. 电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com