
【题目】下列有关物质性质的比较顺序中,不正确的是![]()
A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li<Mg<Si<Ar
【答案】A
【解析】A、同主族非金属元素的气态氢化物的热稳定性可由其非金属性强弱去判断,B、微粒半径大小的比较遵循先看电子层数、再看核电荷数、最后看电子数的顺序进行判断,C、非金属元素最高价含氧酸的酸性强弱由其对应的非金属性强弱决定,D、根据电子排布规律可确定元素的原子最外层电子数的多少。
A、第ⅦA自上而下依次为F、Cl、Br、I,它们的非金属性依次减弱,所以形成的气态氢化物的热稳定性也依次减弱,即HF>HCl>HBr>HI,故A不正确;
B、K+是288型离子,Na+、Mg2+、Al3+都是28型离子,且核电荷数依次增大,所以半径依次减小,因此离子半径为K+>Na+>Mg2+>Al3+,故B正确;
C、第三周期非金属元素从左到右依次为Si、P、S、Cl,根据同周期非金属性变化规律,它们的非金属性依次增强,所以最高价含氧酸的酸性依次增强,故C正确;
D、已知Li、Mg、Si、Ar的核电荷数分别为3、12、14、18,根据电子排布规律可得,它们最外层电子数分别为1、2、4、8,所以D正确。本题答案为A。


科目:高中化学 来源: 题型:
【题目】图甲~丁中关于海带提取碘的部分实验操作及目的正确的是

A. 装置甲的作用是使海带中I2升华
B. 装置乙加H2O2发生置换反应生成I2
C. 装置丙用于富集水溶液中的I2
D. 装置丁用于分离I2和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的______________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含______(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O Ba2++CrO42﹣═BaCrO4↓
步骤Ⅰ:移取x ml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0 mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的______________(填“上方”或“下方”)。BaCl2溶液的浓度为______________ molL-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,若该分子中仅含有3个甲基(—CH3),则其一氯取代物最多有( )种(不考虑立体异构)
A. 7 B. 8 C. 9 D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
组 | A槽 | B槽 |
1 | NaCl | AgNO3 |
2 | AgNO3 | CuCl2 |
3 | Na2SO4 | AgNO3 |
4 | NaOH | CuSO4 |

①工作一段时间后A槽pH上升,B槽的pH下降;
②b、c两极上反应的离子的物质的量相等。
(1)应选择的电解质是上述四组中的第________组。
(2)该组电解过程中各电极上的电极反应为:a极___b极____c极___ d极____
(3)当b极上析出7.1 g电解产物时,a极上析出产物的质量为________g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图。
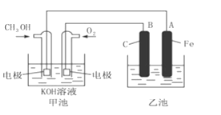
下列说法中不正确的是
A. 甲池的总反应式为:2CH3OH+3O2+4KOH== 2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为4OH--4e- = 2H2O+O2↑
C. 若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
D. 常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为CH3OH(l)+1.5O2(g) ==CO2(g)+2H2O(l) ΔH= -725.80 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 将1molCl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100 g CaCO3晶体和136 g KHSO4晶体中含有的离子数分别为2 NA 和3 NA
C. 3mol Fe在纯氧中完全燃烧转移的电子数为8NA
D. 已知:N2(g)+3H2(g) ![]() 2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )

A. a点溶液的pH=2
B. c点溶液中:c(Yˉ)>c(Na+)>c(HY)>c(H+)>c(OHˉ)
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. 水的电离程度:a<b<c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com