
【题目】甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
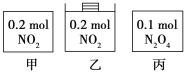
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
【答案】B
【解析】
甲、乙存在平衡2NO2N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大;但平衡移动的结果是降低NO2浓度的增大,不会消除增大;反应混合气体的总质量不变,总的物质的量减小,混合气体的平均摩尔质量增大;
丙中存在平衡N2O42NO2,相当于开始加入0.2molNO2,与甲为等效平衡,NO2浓度、N2O4的百分含量、混合气体的平均摩尔质量与甲中相同。平衡时甲、丙中N2O4的物质的量相等,平衡时甲中NO2 与丙中N2O4 的转化率之和等于1。
甲、乙存在平衡2NO2N2O4,该反应为气体物质的量减小的反应,故甲中压强减小,乙中压强不变,乙中到达的平衡相当于在甲平衡的基础上增大压强,丙中存在平衡N2O42NO2,相当于开始加入0.2molNO2,与甲为等效平衡,
A. 甲与丙为完全等效平衡,平衡时NO2浓度的相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,但平衡移动的结果是降低NO2浓度的增大,不会消除增大,故平衡时容器内c(NO2)的大小顺序为乙>甲=丙,故A错误;
B. 甲与丙为完全等效平衡,平衡时N2O4的百分含量相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,平衡时N2O4的百分含量增大,故平衡时N2O4的百分含量:乙>甲=丙,故B正确;
C. 甲与丙为完全等效平衡,平衡时甲、丙中N2O4的物质的量相等,平衡时甲中NO2与丙中N2O4的转化率之和等于1,故平衡时甲中NO2 与丙中N2O4 的转化率可能相同,都为0.5,故C错误;
D. 甲与丙为完全等效平衡,平衡时混合气体的平均摩尔质量相等,乙中到达的平衡相当于在甲平衡的基础上增大压强,增大压强平衡向正反应移动,总的物质的量减小,乙中平均摩尔质量增大,故平衡时混合物的平均相对分子质量:乙>甲=丙,故D错误;
答案选B。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323K,NaClO2溶液浓度为5×10-3molL-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO | SO | NO | NO | Cl- |
c/(molL-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___。增加压强,NO的转化率___(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___ (填“增大”、“不变”或“减小”)。
③由实验结果可知,脱硫反应速率脱硝反应速率___ (填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___ (填“增大”、“不变”或“减小”)。
②反应ClO![]() +2SO
+2SO![]() =2SO
=2SO![]() +Cl-的平衡常数K表达式为___。
+Cl-的平衡常数K表达式为___。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)________(填“>”“<”或“=”)v(逆),随后v(正)逐渐______(填“增大”或“减小”,下同),v(逆)逐渐________,反应达到平衡时,V(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则V(N2)=____v'(H2)。
(3)下列措施中不能加快反应速率的是___________(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氦气
(4)写出合成氨反应N2+3H2![]() 2NH3的平衡常数表达式:_____________________________。
2NH3的平衡常数表达式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的定容密闭容器中,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g), 下列哪种情况,能表明反应达到平衡状态
2SO3(g), 下列哪种情况,能表明反应达到平衡状态
A. SO2速率是O2速率的2倍
B. SO3的浓度是O2浓度的2倍
C. SO3的质量分数保持不变
D. 单位时间内SO2消耗的浓度等于SO3生成的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如下所示的是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子。当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是
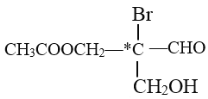
A. 与乙酸发生酯化反应 B. 与NaOH水溶液反应
C. 催化剂作用下与H2反应 D. 与银氨溶液作用只发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
2mL1mol/LBaCl2溶液 4mL1mol/LNaHCO3溶液 | 2mL1mol/LBaCl2溶液 4mL1mol/LNa2SO3溶液 | 2mL1mol/LBaCl2溶液 4mLH2SO3溶液 |
A.实验①中生成的沉淀是BaCO3
B.实验①中有气体生成
C.实验②沉淀中可能含有BaSO4
D.实验③生成沉淀的离子方程式是:Ba2++H2SO3=BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
A.x的值是2
B.开始时B的物质的量为3mol
C.5min时,B的物质的量浓度为1.5 mol·L-1
D.5min时,容器中气体总的物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有![]() 和N5-两种离子)的重要中间体。下列说法中不正确的是( )
和N5-两种离子)的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源B.每个N5+中含有5个原子核
C.每N5-中含有36个质子D.N10结构中含非极性共价键和离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向 10mL 0.01 mol/L NaCN 溶液中逐滴滴加 10mL0.01 mol/L 的盐酸,其 pH 变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)
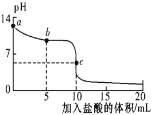
A.a 点溶液的 pH ≥12
B.b 点的溶液:c(CN-)> c(Cl-)>c(HCN )
C.pH =7 的溶液:c(Na+)+ c(H+) =c(Cl-)+ c(CN-)
D.c 点的溶液:c(CN-)+c(HCN ) +c(Cl-)=0.01 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com