
| A.(1)(2)(3) | B.(1)(3)(4) | C.(2)(4) | D.(1)(4) |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
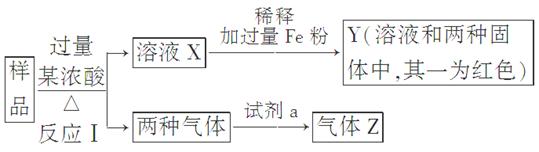
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4.8g | B.4.4g | C.4.5g | D.4.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
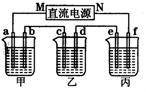
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
 Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al。1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约_______吨(小数点后保留一位数字)。
Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al。1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约_______吨(小数点后保留一位数字)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al、Fe | B.Fe、Si | C.Al、Si | D.Zn、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com