
有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )
A.BaCl2、H2SO4、MgCl2 B.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaCl D.BaCl2、HCl、NaNO3
科目:高中化学 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
为研究硫酸铜的量对锌与稀硫酸反应氢气生成速率的影响,该同学设计了如下一系列实验。表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。下列说法正确的是
实验 混合溶液 | A | B | C | D | E | F |
4mol/LH2SO4溶液 | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
A. V1=30,V6=10
B.反应一段时间后,实验A,E中的金属呈暗红色
C.加入MgSO4与Ag2SO4可以起与硫酸铜相同的加速作用
D.硫酸铜的量越多,产生氢气的速率肯定越快
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:选择题
已知:①H2(g)+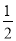 O2(g)=H2O(g) ΔH1=a kJ·mol-1
O2(g)=H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+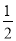 O2(g)=H2O(l) ΔH3=c kJ·mol-1
O2(g)=H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.c<a<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高一阶段考一化学卷(解析版) 题型:填空题
(1)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
①混合气体的平均摩尔质量是___________________。
②混合气体中所含碳原子的物质的量是_____________________。
③CO2和CO的体积之比是_______________________。
(2)标准状况下有①0.112 L水 ②0.5NA个HCl分子③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol He 所含原子个数从大到小的顺序为__________________。
(3)将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是_______________。(用含c1 和c2的代数式表示)
(4)某温度时,一定量的元素A的气态氢化物AH3,在恒温密闭容器中分解为两种气体单质,此时压强增加了75%,则AH3分解反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高一阶段考一化学卷(解析版) 题型:选择题
化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是( )
①检验CO的纯度,简单方法是用排空气法先收集一试管气体,点燃,听爆鸣声;②实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室;③给试管中的液体加热,不时移动试管或加入碎瓷片,以免暴沸伤人;④不慎将浓硫酸溅到皮肤上,应立即用布拭去,再用大量水冲洗,然后涂稀小苏打溶液。
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高一阶段考一化学卷(解析版) 题型:选择题
读下列药品标签,有关分析不正确的是( )
选项 | A | B | C | D |
物品标签 | 氢氧化钠固体 | 药品:浓硝酸 | 碳酸氢钠NaHCO3 | 浓硫酸H2SO4密度1.84g·mL-1 |
分析 | 该药品应装在带橡胶塞的广口瓶中密封保存 | 该药品标签上标有 | 受热易分解 | 该药品标签上标有 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上第一次月考化学卷(解析版) 题型:选择题
V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2V L
B.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩到0.5V L
D.加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源:2016-2017年黑龙江哈尔滨师大附中高二10月月考化学卷(解析版) 题型:实验题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有____________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
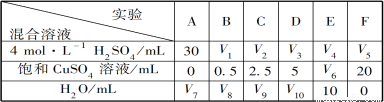
请完成此实验设计,其中:V1=___________,V6=___________,V9=___________;
反应一段时间后,实验A中的金属呈___________色,实验E中的金属呈___________色;
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com