
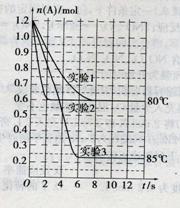
 ��1.2mol��A�������2L�����ܱ������з�����Ӧ��A(g)
��1.2mol��A�������2L�����ܱ������з�����Ӧ��A(g) ![]() 2B(g)�������ֲ�ͬ�����½���ʵ�飬A�����ʵ�����ʱ��ı仯��ͼ��ʾ���Իش��������⣺
2B(g)�������ֲ�ͬ�����½���ʵ�飬A�����ʵ�����ʱ��ı仯��ͼ��ʾ���Իش��������⣺
��1��ʵ��1�У���Ӧ��4s��A��ƽ����Ӧ������ ��4sʱA��ת����Ϊ ���������¸÷�Ӧ��ƽ�ⳣ��K1��ֵΪ ��
��2��ʵ��2��ʵ��1�Աȣ�����������ķ�Ӧ������ ��
��3������ʵ��3��ʵ��1��ͼ��Ƚϣ����Ʋ�÷�Ӧ�� ������ȡ������ȡ�����Ӧ����ʵ��1��3��ƽ�ⳣ����ֵ�ֱ�ΪK1��K2��K3��������֮��Ĺ�ϵΪK1 K2 K3���>������<����=������
��4��Ϊ����֤��������ı������ѹǿ�����ѧ��Ӧ������һ���ۣ�ijͬѧ���±�ʵ��1�Ļ����������ø����������ʵ��4��5������ʵ�����������ݼ��±���
��������±���������ͼ�����ʵ��4��5��A�����ʵ�����ʱ��仯��������ͼ��
| ʵ���ż���Ŀ�� | V(�ݻ�)/L | t/�� | n(A��ʼ)/mol | n(B��ʼ)/mol | ����������/g | �����ı����/m2��g��1 |
| ʵ��1 ���նԱ�ʵ�� | 2 | 80 | 1.2 | 0 | a | b |
| ʵ��4�������ı�����Է�Ӧ���ʵ�Ӱ�� | ||||||
| ʵ��5Ŀ�ģ�
| 1 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
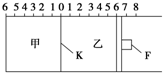 ��ͼ��ʾ���ס���֮��ĸ���K�ͻ���F���������ƶ������г���2mol SO2��1mol O2�����г���2mol SO3��1mol He����ʱKͣ��0������һ�������·������淴Ӧ��2SO2��g��+O2��g��?2SO3��g������Ӧ�ﵽƽ����ٻָ���ԭ�¶ȣ��ش��������⣺
��ͼ��ʾ���ס���֮��ĸ���K�ͻ���F���������ƶ������г���2mol SO2��1mol O2�����г���2mol SO3��1mol He����ʱKͣ��0������һ�������·������淴Ӧ��2SO2��g��+O2��g��?2SO3��g������Ӧ�ﵽƽ����ٻָ���ԭ�¶ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ���ס���֮��ĸ���K�ͻ���F���������ƶ������г���2mol SO2��1 mol O2�����г���2 mol SO3��1 mol He����ʱKͣ��0������һ�������·������淴Ӧ��2SO2(g)��O2(g)2SO3(g)����Ӧ�ﵽƽ����ٻָ���ԭ�¶ȡ��ش��������⣺
�ﵽƽ������K�Ƿ���ܴ���0�̶�________(����ܡ������ܡ�)����K����ͣ����0�̶����a������aһ��С��________��
��2����ƽ��ʱ��K����ͣ�������̶�1���������SO3�����ʵ���Ϊ________mol������SO3��ת����________50%(�>������<������)������F����ͣ�����Ҳ�̶�________��(��������ţ���<6����>6���ۣ�6)��
��3����һ��ʼ�ͽ�K��F�̶����������������䣬��ƽ��ʱ���ס�����SO3�����ʵ��������Ǽ�________��(�>������<������)����ü���SO2��ת����Ϊw%��������SO3��ת���ʵ���________��
��4��ƽ��������Ļ������1.0%ͨ������Ba(NO3)2��Һ�����ɵ�BaSO4����Ϊ________�ˡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com