
(12分)(1)有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体。A完全燃烧后生成二氧化碳与水物质的量之比是2:1;B的分子量是A的三倍;C既不能使酸性高锰酸钾溶液褪色也不能使溴水褪色,但在光照条件下最多可与六倍体积氯气发生反应;燃烧相同物质的量C与D,生成二氧化碳的体积比为1:4,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,在催化剂作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。试推断有机物A、B、C、D,分别写出结构简式:
A:______________ B:_____________
C:______________ D:___________
(2)相对分子质量为72的某烃,其分子式是___________,若此有机物的一氯代物分子中有两个-CH3、两个-CH2-、一个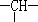 和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
【解析】(1) A完全燃烧后生成二氧化碳与水物质的量之比是2:1,根据原子守恒可知A中碳原子和氢原子的个数比是1︰1,又因为A是气体,所以A是乙炔。B的分子量是A的三倍,则B的分子式为C6H6。因为B是液体,所以B是苯。根据C的性质可知C应是烷烃,在光照条件下最多可与六倍体积氯气发生反应,所以C是乙烷。燃烧相同物质的量C与D,生成二氧化碳的体积比为1:4,因此D中含有8个碳原子。根据D的性质可判断D是苯的同系物。在铁粉存在下与溴反应生成一溴代物只有一种,所以D是对二甲苯。
(2)因为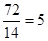 ……2,所以是烷烃,分子式为C5H12.2个甲基最多1个是支链,若2个甲基都不是支链,则氯原子的位置有2种,即2-氯戊烷和3-氯戊烷。若其中1个甲基是取代基,则甲基支链的位置也是2种,即3-甲基-1-氯丁烷和2-甲基-1-氯丁烷。
……2,所以是烷烃,分子式为C5H12.2个甲基最多1个是支链,若2个甲基都不是支链,则氯原子的位置有2种,即2-氯戊烷和3-氯戊烷。若其中1个甲基是取代基,则甲基支链的位置也是2种,即3-甲基-1-氯丁烷和2-甲基-1-氯丁烷。
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
( 12 分)(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
。
②溶液a中存在的阴离子有__________________;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________;为此,改进方法是 。
(2)该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物测定生成气体的体积
方案Ⅱ:镁铝混合物测定剩余固体的质量
下列有关判断中不正确的是 (填代号)
A.溶液A选用NaOH溶液
B.若溶液B选用浓硝酸,则测得镁的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
(每空2分,共12分).
(1)下列说法不正确的是 。
A.用100mL的容量瓶准确量取100mL液体
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
C.用托盘天平称量NaCl固体时,NaCl放在称量纸上,称量NaOH固体时,NaOH放在小烧杯里
(2)回答下列问题(填序号):
下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥量筒⑦燃烧匙。
常用于物质分离的是 ,其中根据物质沸点不同来分离物质的仪器是 。
(3)用适当的试剂或方法除去下列物质中所混有的少量杂质,写出有关的反应方程式。
铁粉中混有少量铝粉 ;
FeCl3中混有少量FeCl2 ;
固体 Na2CO3中混有少量NaHCO3 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省南山中学高一5月月考化学试卷(带解析) 题型:填空题
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一5月月考化学试卷(解析版) 题型:填空题
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。

①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是_______________ ____,
(2)同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是_________ ________,
(3)当其c(H+)相同时,物质的量浓度由大到小的顺序为________________ _____,
(4)当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为_______________。
(5)当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则:
开始时反应速率__________________,反应所需的时间__ _____ ____。
 www.ks5.u.com
www.ks5.u.com
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com