
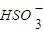 +H2O?H2SO3+OH-①
+H2O?H2SO3+OH-①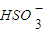 ?H++
?H++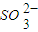 ②,向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
②,向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )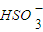 )增大
)增大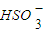 )+c(OH-)+
)+c(OH-)+ c(
c(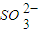 )
)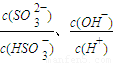 的值均增大
的值均增大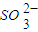 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)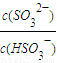 ,
,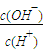 比值增大,故C正确;
比值增大,故C正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | Na2S等 Na2S等 |
FeS2 | S | Na2S2O3 | SO2等 SO2等 |
SO3或H2SO4或Na2SO4 | Na2S2O8 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com