
【题目】下列过程属于化学变化的是( )
A. 过滤B. 分液
C. 裂化D. 蒸馏
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,浓H2SO4既表现强氧化性又表现酸性的是( )
A. 2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C. S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
D. Fe2O3+3H2SO4(浓) ===Fe2(SO4)3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,已知乙炔二聚反应如下:![]()
三聚同理,现以乙炔为原料在一定条件下发生如下转化:
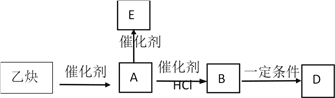
其中A为乙炔的二聚产物;E为乙炔的三聚产物,E分子中有四个碳原子在一条直线上,高分子D的结构为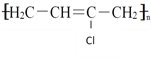 。 回答下列问题:
。 回答下列问题:
(1)乙炔的电子式为_______________________。
(2)用电石制取乙炔的方程式为_____________________________________________。
(3)净化乙炔时,可用_______________(填试剂)除去其中的H2S、PH3等杂质气体。
(4)B的结构简式为______________________,A→B的反应类型为_________________。
(5)E的结构简式为_______________________________。
(6)已知环己烯可由下列物质在一定条件反应下得到:
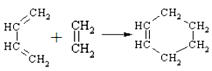 (也可表示为:
(也可表示为: 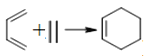 )
)
有机物B在一定条件下反应,生成含六元环的二氯代烃G,G分子式为C8H10Cl2,写出G的结构简式
____________________________(任写两种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到氯丁橡胶和富马酸。

(1)B的名称为2-氯-1,4-丁二醇,请你写出B的结构简式____________________。
(2)请你写出第①步反应的化学方程式:________________________________________。
(3)反应①~⑥中,属于消去反应的有______________________________。有机合成中路线和步骤的选择非常重要。
(4)有机合成中的路线和步骤选择非常重要,若将第②步与第③步的顺序调换,则B结构将是____________________。
(5)如果没有计算③和⑥这两步,直接用KMnO4/H+处理物质A,导致的问题是:____________________________________________________________。
(6)某种有机物的分子式为C2H4O4,它的分子中所含官能团的种类、数目均与富马酸相同,不考虑顺反异构,它可能的结构有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活和社会可持续发展关系密切。下列措施正确的是
①将酒精和84消毒液混用,提高杀灭新冠病毒的效果;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料
A.①③⑤B.②③⑤C.①②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:
①25℃,Ksp(PbS)=1.0×10-28,Ksp(PbCl2)=1.6×10-5
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+以氢氧化物形式开始沉淀时的pH值为1.9
(1)由于Ksp(PbS)﹤Ksp(PbCl2),PbS+2HCl![]() PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
(2)步骤②中饱和食盐水的作用是_________________________。
(3)步骤③中滤液A经过蒸发浓缩、用冰水浴冷却结晶后,还需进行的操作是__________(填操作名称)。
(4)步骤④中,若加入稀硫酸充分反应后所得悬浊液中c(Cl-)=1.0mol·L-1,则c(SO42-)=________[Ksp(PbSO4)=1.6×10-8]。步骤⑤中滤液B用适量试剂X处理后可循环利用,试剂X应选用下列中的_____(填标号)。
a.HNO3 b.Cl2 c.H2O2 d.铁粉
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液后先变浑浊,继续滴加NaOH溶液又变澄清,pH为13~14时,溶液中发生的主要反应的离子方程式为__________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂(DH)“捕捉”金属离子,从而去除水中的痕量铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度/(mg·L-l) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度/(mg· L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+(aq)![]() D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证实氢氧化钡溶液和硫酸溶液的反应是离子反应,实验设计和过程如下:如图所示连接好装置,向烧杯中加入25 mL 1 mol·L-1的氢氧化钡溶液和2滴酚酞溶液,再一边不断地滴加1 mol·L-1的硫酸溶液,并轻轻振荡。试完成下列内容:

(1)实验现象及①溶液颜色变化为______,原因是________。
②灯泡亮度变化:__________,原因是_______。
③溶液变浑浊,原因是___________。
(2)实验结论:稀硫酸与氢氧化钡溶液反应的实质是_____(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com