
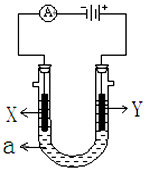
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 ①若X、Y都是惰性电极,a是饱和NaCl溶液,X是阴极、Y是阳极,Y电极上氯离子放电生成氯气,X电极上氢离子放电,同时该电极附近生成氢氧根离子;
②若要在铁制品上镀一定厚度的Cu层,镀层作阳极、镀件作阴极,电解质溶液为含有铜离子的可溶性盐溶液;
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到11.2L氯气时(标准状况),n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,转移电子的物质的量=0.5mol×2=1mol,阴极增重32g,根据转移电子守恒知,阴极上转移1mol电子,MCl2中M化合价为+2价,要转移1mol电子,则析出0.5molM单质,该金属的摩尔质量=$\frac{32g}{0.5mol}$=64g/mol,金属单质的摩尔质量在数值上等于其相对原子质量.
解答 解:①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,同时该电极附近有OH-生成,导致溶液碱性增强,滴入几滴酚酞试液会变红,
故答案为:X;2H++2e-=H2↑;
②若要在铁制品上镀一定厚度的Cu层,镀层作阳极、镀件作阴极,电解质溶液为含有铜离子的可溶性盐溶液,则Cu作阳极、Fe制品作阴极,Y为阳极,电极反应式为Cu-2e-=Cu 2+,
故答案为:Cu-2e-=Cu 2+;
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到11.2L氯气时(标准状况),n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,转移电子的物质的量=0.5mol×2=1mol,阴极增重32g,根据转移电子守恒知,阴极上转移1mol电子,MCl2中M化合价为+2价,要转移1mol电子,则析出0.5molM单质,该金属的摩尔质量=$\frac{32g}{0.5mol}$=64g/mol,金属单质的摩尔质量在数值上等于其相对原子质量,所以其相对原子质量为64,
故答案为:64.
点评 本题以电解原理为载体考查电解、电镀及有关计算,为高频考点,明确电解原理内涵及各个物理量之间的关系是解本题关键,侧重考查学生分析计算能力,注意③要灵活运用转移电子守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
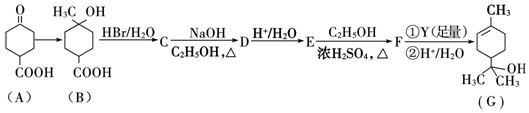
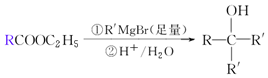
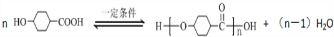 .
. .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26.3 | B. | 13.2 | C. | 19.8 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 金溶于王水生成AuCl4-离子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol) | |
| B. | 17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol) | |
| C. | 2g氢气所含原子数目为NA (提示:M(H2)=2g/mol) | |
| D. | 常温常压下,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4 mol硫被氧化 | |
| D. | 每转移1.2 mol电子,有0.3 mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯可用饱和Na2CO3溶液鉴别 | |
| B. | 除去乙烷中少量的乙烯,可在光照条件下通入Cl2 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、纤维素、油脂都是高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com