解:(1)戊中固体NaCl质量29.25g,钠离子守恒可知NaBr、NaI的物质的量之和等于NaCl的物质的量,即
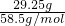
=0.5mol,
由钠离子守恒可知反应后蒸干灼烧得到的固体的物质的量不变为0.5mol,
将反应甲至戊视作每次增加vml氯气计算,因还原性I
->Br
->Cl
-,故先有2NaI+Cl
2=2NaCl+I
2…①,反应完后再有2NaBr+Cl
2=2NaCl+Br
2…②.
①对于甲,固体平均摩尔质量为
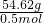
=109.24g/mol,所以甲固体中一定含有NaI,所以甲固体的组成为NaI、NaBr、NaCl;
②对于乙视作甲增加vml氯气,导致固体质量减少为54.62g-43.64g=10.98g,
对于丙视作乙增加vml氯气,导致固体质量减少为43.64g-35.48=8.16g,
相同体积的氯气与同种离子发生反应,蒸干灼烧得到固体的质量减少相等.由于乙与丙后加入的vml氯气使固体的质量减少不相等,所以丙固体中一定不含有NaI,
再根据丁、戊继续通入氯气蒸干灼烧得到固体的质量还在减少,所以丙固体的组成为NaBr、NaCl;
③对于戊视作丁增加vml氯气,蒸干灼烧得到固体的质量还在减少,结合丙固体的组成为NaBr、NaCl,说明丁固体的组成为NaBr、NaCl.
④丁中最后vml氯气与NaBr反应,vml氯气完全反应,且有NaBr剩余,令vml氯气的物质的量为n,则
Cl
2+2NaBr=2NaCl+Br
2 固体减少
1mol 160g-71g=89g
n 35.48g-30.14g=5.34g
所以n=0.06mol
即vml氯气的物质的量为0.06mol.
对于乙视作甲增加vml氯气,导致固体质量减少为54.62g-43.64g=10.98g,因还原性I
->Br
->Cl
-,故先有2NaI+Cl
2=2NaCl+I
2,反应完后再有2NaBr+Cl
2=2NaCl+Br
2.
vml氯气与NaI反应导致固体质量减少最多
2NaI+Cl
2=2NaCl+I
2 固体减少
1mol 254g-71g=183g
0.06mol a
所以a=10.98g,等于甲通入vml氯气导致固体质量减少,所以乙最后通入vml氯气只与NaI反应.
对于丙视作乙增加vml氯气,导致固体质量减少为43.64g-35.48=8.16g,vml氯气与NaBr反应导致固体质量减少最少为35.48g-30.14g=5.34g,小于8.16g,
故丙中最后vml氯气,既与NaI反应又与NaBr反应.
由上述分析可得:固体乙的组成为NaI、NaBr、NaCl;
故答案为:NaI、NaBr、NaCl;NaI、NaBr、NaCl;NaBr、NaCl;NaBr、NaCl;
(2)由(1)计算可知vml氯气的物质的量为0.06mol,标准状况下体积为0.06mol×22.4L/mol=1.344L=1344mL,
由于乙最后通入vml氯气只与NaI反应,甲通入vml氯气导致固体质量减少等于乙最后通入vml氯气导致固体质量减少,
所以原溶液中NaI与NaBr的总质量为54.62g+10.98g=65.6g,
令原溶液中NaI的物质的量为xmol,NaBr的物质的量为ymol,则
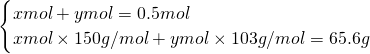
,解得x=0.3,y=0.2.
故答案为:1344mL;0.2mol.
分析:(1)本题为卤素单质间的置换反应,向NaBr、NaI的混合溶液中通入Cl
2,需考虑置换反应发生的先后,因还原性I
->Br
->Cl
-,故先有2NaI+Cl
2=2NaCl+I
2…①,反应完后再有2NaBr+Cl
2=2NaCl+Br
2…②.将反应甲至戊视作每次增加vml氯气计算,相同体积的氯气与同种离子发生反应,蒸干灼烧得到固体的质量减少相等,再根据固体质量差量进行判断;
(2)根据丁最后加入的vml氯气,导致蒸干灼烧得到固体的质量减少,计算v的值;
由表可知NaCl的质量为29.25g,由钠离子守恒可知NaBr、NaI的物质的量之和为0.5mol.根据固体质量差量进行判断,乙最后通入vml氯气只与NaI反应,甲通入vml氯气导致固体质量减少等于乙最后通入vml氯气导致固体质量减少,所以原溶液中NaI与NaBr的总质量为54.62g+10.98g=65.6g,据此列方程求解.
点评:本题以卤素单质及化合物的性质为载体,考查化学计算与思维分析能力,难度比较大,本题关键在于1、根据钠离子守恒可知蒸干灼烧得到固体的物质的量为定值0.5mol,进而确定甲固体的成分.2、相同体积的氯气与同种离子发生反应,蒸干灼烧得到固体的质量减少相等,由丙固体质量入手判断.3、确定乙中乙最后通入vml氯气只与NaI反应及确定乙固体的成分.

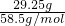 =0.5mol,
=0.5mol,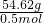 =109.24g/mol,所以甲固体中一定含有NaI,所以甲固体的组成为NaI、NaBr、NaCl;
=109.24g/mol,所以甲固体中一定含有NaI,所以甲固体的组成为NaI、NaBr、NaCl; 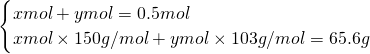 ,解得x=0.3,y=0.2.
,解得x=0.3,y=0.2.
