
【题目】根据下列事实,完成相关的离子方程式或化学式,必要时可加一定文字说明:
(1)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂_____________________。
(2)泡沫灭火器的化学原理________________________________________________。
(3)热的纯碱溶液清洗油污___________________________________________。
(4)加热蒸干FeCl2水溶液并灼烧,得到物质的化学式为___________。
【答案】 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3++3HCO3-=Al(OH)3↓+3CO2↑ CO32-+H2O
Al(OH)3(胶体)+3H+ Al3++3HCO3-=Al(OH)3↓+3CO2↑ CO32-+H2O![]() HCO3-+OH-,加热可以促进水解,溶液碱性增强 Fe2O3
HCO3-+OH-,加热可以促进水解,溶液碱性增强 Fe2O3
【解析】(1)明矾净水的原理是氯离子水解得到氢氧化铝胶体,胶体吸附水中杂质,所以离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)泡沫灭火器中加入的是碳酸氢钠和硫酸铝,利用其双水解反应,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(3)热的纯碱溶液清洗油污是利用碳酸钠水解得到的碱与油污发生皂化反应,以除去油污,加热是为了促进碳酸根离子的水解,增强溶液的碱性。反应为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
(4)加热蒸干FeCl2水溶液并灼烧,氯化亚铁水解得到氢氧化亚铁和HCl,因为HCl挥发,所以水解平衡移动,得到的氢氧化亚铁被氧化为氢氧化铁,分解得到氧化铁。
【题型】填空题
【结束】
19
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。

(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。滴定达到终点的标志是:_________。
(4)根据下列数据,烧碱的纯度为:_______________________(纯度=纯物质的质量/样品的质量×100%)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
<>①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)计算:血液中含钙离子的浓度为_____mol·L-1。
【答案】 胶头滴管 100mL容量瓶 A 锥形瓶内颜色的变化 最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原 80% 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 酸式 2.5×10-3
【解析】(一)(1)配制一定浓度的溶液,需要用到100mL的容量瓶,还需要胶头滴管定容。
(2)待测的氢氧化钠溶液应该使用碱式滴定管,选择A。
(3)滴定时眼睛应该注意锥形瓶内液体颜色的变化,达到终点时要及时停止滴定。滴定终点的现象为:溶液红色褪去且30s不复原,所以答案为:最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原。
(4)两次滴定加入的盐酸的体积分别为19.90mL和20.10mL,所以平均为20.00mL,所以HCl的物质的量为20×0.5÷1000=0.01mol,所以氢氧化钠为0.01mol,因为配了100mL溶液取出10mL进行的滴定,所以原来的氢氧化钠为0.1mol,质量为4g,质量分数为4÷5=80%。
(二)(1)KMnO4滴定H2C2O4的方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑ + 8H2O,对应的离子方程式为:2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O(草酸是弱酸不能拆分)。
(2)高锰酸钾具有强氧化性,会氧化碱式滴定管下端的橡胶管,所以只能用酸式滴定管盛放。
(3)根据反应的整个过程,得到如下的关系式Ca2+~CaC2O4~H2C2O4~2/5 KMnO4,所以Ca2+是KMnO4的5/2倍。高锰酸钾为20×1×10-4÷1000=2×10-6mol,所以Ca2+为5×10-6mol,所以浓度为5×10-6÷0.002=2.5×10-3mol/L。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】已知:H2(g)+ ![]() O2(g)H2O(l),反应过程中能量变化如图所示,则:
O2(g)H2O(l),反应过程中能量变化如图所示,则:
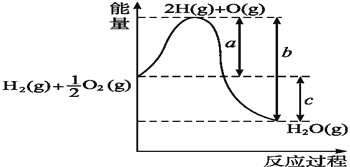
①a、b、c分别代表什么意义?
a___________________________________;
b_____________________________;
c___________________________________。
②该反应是______反应(填“吸热”或“放热”),ΔH_______0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是______。(请写两条)
(3)已知:H2(g)+ ![]() O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(l)H2(g) ΔH=+0.92 kJ·mol-1
O2(l)O2(g) ΔH=+6.84 kJ·mol-1
请写出1mol液氢和液氧生成液态水的热化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸镓在激光材料的制备中已成为重要的基础和主要原料。以废催化剂GCS(主要成分为Ga2O3、Cr2O3和SiO2)为原料制备硝酸嫁晶体的工艺流程如下:

(1)滤渣的主要成分是______(写化学式),用稀氨水调节溶液pH至3.0~3.5之间的目的是________。
(2)用硝酸溶解时,温度应控制在40~80℃,实验室控制该温度区间的方法是______;温度高于80℃,溶解速率减慢,其原因是____________。
(3)采用减压蒸馏的目的是_________________。
(4)催化剂GCS可用于催化热乙烯还原一氧化氮,以消除尾气排放对大气的污染,写出该反应的化学方程式:________________。
(5)用硝酸镓制备含镓、铱和铂的催化剂可以有效地催化正庚烷转化为甲苯,该反应的化学方程式为________________。
(6)硝酸镓晶体加热过程中,固体失重率[失重率=![]() ]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。
]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的核外电子排布式为1s22s22p6,下列关于该微粒的说法一定正确的是( )
A. 质子数为10 B. 单质具有还原性
C. 是单原子分子 D. 电子数为10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是重要的科学研究方法,下列物质分类不正确的是
A. 电解质:明矾、一水合氨、硫酸钡
B. 酸性氧化物: ![]() 、
、![]() 、
、![]() 、
、![]()
C. 混合物:铝热剂、矿泉水、水玻璃、漂白粉
D. 同素异形体: ![]() 、
、![]() 、金刚石
、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中加入金属锌有H2放出,则在该溶液中一定能大量共存的是( )
A.Cu2+ Cl﹣ K+ SO42﹣
B.Na+ NO3﹣ OH ﹣ CO32﹣
C.Ba2+ Cl﹣ NO3﹣ SO42﹣
D.K+ Na+ Cl﹣ SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
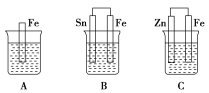
(1)A中反应的离子方程式为_____________________________________。
(2)B中Sn极的电极反应式为___________________________________。
(3)C中被反应掉的金属是________,总反应的化学方程式为_________,比较A、B、C中铁反应的速率,由快到慢的顺序为____________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com