
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
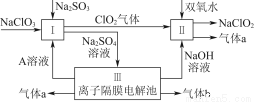
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_____________________________________________________________________________________________________________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2 的原因:________________________________________________________________________
________________________________________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
(1)H—O—O—H Na2SO3
(2)2ClO2 +H2O2+2OH-=2ClO2-+O2↑+2H2O
(3)H2SO4 阳
(4)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O ClO2-+3Cl-+4H+=2Cl2↑+2H2O
(5)相同
【解析】(1)NaClO3中Cl原子化合价为+5价,具有很强的氧化性,而SO32-在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO3,还原剂是Na2SO3;(2)电解Na2SO4溶液相当于电解水,由气体a、b是Na2SO4溶液的电解产物可知为H2和O2,由气体a为反应Ⅱ的产物之一可知其为O2,为H2O2被ClO2氧化得到的产物,故反应Ⅱ的反应物为ClO2、H2O2和NaOH,生成物有NaClO2和O2,根据电子守恒和原子守恒配平即可;(3)电解Na2SO4溶液时OH-在阴极生成,故Na+通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H+,SO42-向阳极移动得到产物A(即H2SO4溶液);(4)①由题意可知反应物为NaClO2和HCl,其中NaClO2中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO2自身的氧化还原反应,根据电子守恒可知氧化产物ClO2和还原产物Cl-的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl2则ClO2-和HCl发生了归中反应,根据电子守恒可知反应的ClO2-和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO2自身的氧化还原反应,无论变质与否,与Fe2+反应时氯元素最终都转化为Cl-,故转移电子数相等。


科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.金刚石、碳化硅、晶体硅的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2-
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为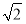 ·
·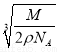 cm
cm
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
分析下列各项物质分子式的规律,按此规律排布第10项的分子式应为( )
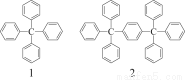
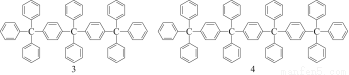
A.C198H146 B.C196H155 C.C196H146 D.C198H155
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
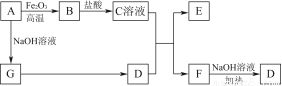
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)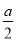 mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
Al、Cu都是重要的金属元素。下列说法正确的是( )
A.两者对应的氧化物均为碱性氧化物
B.两者的单质都能与稀硫酸反应产生氢气
C.常温条件下,两种金属都能溶解于浓硝酸中
D.制备AlCl3、CuCl2,均不能采用将其溶液直接蒸干的方法
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
B.Si、P、S、Cl相应的最高价氧化物对应的水化物的酸性依次增强
C.工业上通常用电解钠、铁、铜对应的氯化物制得这3种金属单质
D.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:填空题
已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:________________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是
________________________________________________________________________。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________ mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
常温下,下列有关醋酸溶液的叙述中不正确的是( )
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)减小
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
下列有关物质的性质或用途的说法中正确的是( )
①氯气具有漂白性,可以直接使有色布条褪色 ②二氧化硫具有较强的还原性,不能用浓硫酸干燥 ③SiO2是酸性氧化物,能与氢氟酸反应 ④Al(OH)3是两性氢氧化物,能溶于强酸或强碱
A.①②③ B.②③④ C.③④ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com