
【题目】下列说法正确的是
A. Li在氧气中燃烧主要生成Li2O2
B. At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强
C. 卤族元素单质的熔、沸点随原子序数的增大而升高
D. 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空:

①上述分类中,分成A、B两组的依据是___________________________;
②C组物质与水反应的离子方程式为________________________________;
③D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有__________(填化学式)。
(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2既体现氧化性又体现还原性的反应是____________;
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是________(填序号);

③H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN)。H2O2被称为绿色氧化剂的理由是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物反应如下图,据此回答下列问题:

(1)乙烯的结构式为: 。
(2)写出反应②④的化学方程式:
② ,反应类型: (1分);
④ ,反应类型: (1分)。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:
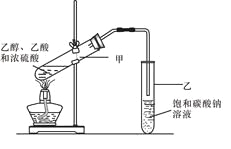
①饱和碳酸钠溶液的主要作用是 。
②若要把制得的乙酸乙酯分离出来,应采用的操作是 。
③进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.一小块钠投入水中:Na+2H2O===Na++2OH-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2===HCO![]()
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质选用的试剂和方法最合理的是
物质 | 杂质 | 试剂 | 方法 | |
A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子的核外电子排布式为[Kr]4d105s1 的元素在元素周期表中的位置是
A.p 区、第五周期第ⅠB 族B.ds 区、第五周期第Ⅷ族
C.d 区、第四周期第ⅠB 族D.ds 区、第五周期第ⅠB 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com