
A.熔点、沸点都较高,难于挥发 B.硬度很小,容易变形
C.都能溶于有机溶剂而难溶于水 D.密度很小
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
A组 | B组 | C组 | D组 |
金刚石:3 | Li: | HF: | NaCl: |
硅晶体:1 | Na: | HCl: | KCl: |
硼晶体:2 | K: | HBI: | RbCl: |
二氧化硅:1 | Rb: | HI: | CsCl: |
据此回答下列问题:
(1)A组属于_____________晶体,其熔化时克服的微粒间的作用力是_________________;
(2)B组晶体共同的物理性质是_____________(填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于__________________________;
(4)D组晶体可能具有的性质是_____________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为NA mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为__________g·mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
现有几种物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。
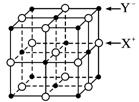
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修3 3.4分子间作用力 分子晶体练习卷(解析版) 题型:填空题
现有几种物质的熔点数据如下表:
A组 B组 C组 D组
金刚石:3550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅1723 ℃ Rb:39 ℃ Hi:-51 ℃ CsCl:645 ℃
据此完成下列问题:
(1)A组属于__________晶体,其熔化时克服的粒子间的作用力是__________。
(2)B组晶体共同的物理性质是__________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于____________________。
(4)D组晶体可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为 __________
g·mol-1。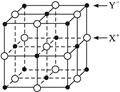
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
第一题:如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ?mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。(2分)
(2)表中X可能为第三周期元素中的 (填元素名称)。Y是周期表中 族元素。
(3)第二周期元素中, (填元素符号)元素原子失去核外第一个电子需要的能量最多。
第二题:现有四组物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 ;
(2)B组晶体共同的物理性质是 (填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性 ⑤易溶于有机溶剂中
(3)C组HF熔点反常是由于 ;
(4)D组晶体可能具有的性质是 (填序号);
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com