


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
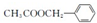 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下: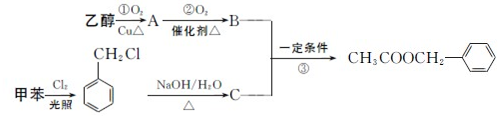
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热时苏打较稳定,小苏打不稳定,易分解 |
| B、相同温度下,小苏打较苏打易溶于水 |
| C、苏打是发酵粉的主要成分之一,也用于治疗胃病 |
| D、小苏打常用作洗涤剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com