
| |||||||||||||||||||||||||||||||
(1) |
������һ��30 mL���Թ���ע��4 mL�Ҵ����ٷֱ�����4 mL���ᡢ1 mLŨ����(�����Ũ����ļ���˳��ɻ���)���ӱ����Թ�ʹ֮��Ͼ��� ���� |
(3) |
��Ϊ��Ӧ���Ҵ�������ķе�ϵͣ����ô����ȣ���Ӧ�����������������ݳ����¶ȹ��߿��ܷ����丱��Ӧ |
(4) |
��dz��ɫ̼������Һ���Ϸ�����ɫҺ�壬�ŵ���ζ����̼������Һ���ɫ��dz��̼���ơ��Ҵ���B |
(5) |
�����𰸣�a���������¶ȼƣ������ڿ��Ʒ���װ���з�ӦҺ�¶� ����b�������˷�Һ©���������ڼ�ʱ���䷴Ӧ���Һ����������������� ����c��������ˮ����װ�ã��������ռ����� ����������ʵ������ȡ��������������Ҫ���л�ʵ��֮һ�����⿼�����Ʊ�����������ԭ������������Ʒ�ľ����Ͷ���װ�õ����۵����ݣ�Ũ������ˮ���Ҵ��������Һ����ʱ����ų��������ȣ�Ϊ��ֹ���ʱҺ��ɽ�������������Ũ�����ϡ����ͬ�� |


 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| T/K | 303 | 313 | 323 |
| ƽ��ʱNH3��������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
| ||
| ||


| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
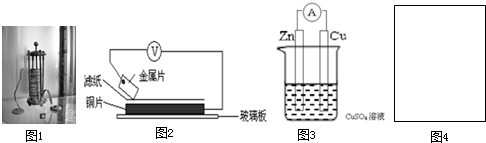
| ���� | ������������ | ��ѹ��V�� |
| A | A��Cu | +0.78 |
| B | Cu��B | -0.15 |
| D | D��Cu | +1.35 |
| E | E��Cu | +0.30 |
 ��������Ӧ��������
��������Ӧ�������� ���������ߣ���
���������ߣ��� �������缫����
�������缫���� ������С���ݣ����Ҳ��ͼ4���ڻ���װ��ͼ��ָ���缫���Ϻ͵������Һ�������Դ����������
������С���ݣ����Ҳ��ͼ4���ڻ���װ��ͼ��ָ���缫���Ϻ͵������Һ�������Դ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ��H��kJ/mol�� |
| H2��g�� | -285.8 |
| CO��g�� | -283.0 |
| CH4��g�� | -890.3 |
| 4n |
| 4n-2na |
| 4n |
| 4n-2na |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?֣�ݶ�ģ��������ѧ��ѧ��Ӧԭ��������������⣺
��2011?֣�ݶ�ģ��������ѧ��ѧ��Ӧԭ��������������⣺| H | + 4 |
| H | + 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol H2��1mol I2 | 2 mol HI | 4 mol HI |
| HI��Ũ�ȣ�mol?L-1�� | C1 | C2 | C3 |
| ��Ӧ�������仯 | �ų�akJ | ����bkJ | ����ckJ |
| ��Ӧ��ת���� | a1 | a2 | a3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������ѧ֪ʶ������������⣺
��������ѧ֪ʶ������������⣺ H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��| �¶�/��C | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| ʱ��/s | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com