
| A. | 浓硫酸密封保存 | |
| B. | 氢氟酸保存在玻璃瓶中 | |
| C. | 新制氯水保存在棕色试剂瓶中 | |
| D. | 烧碱溶液可用带橡皮塞的玻璃瓶暂时保存 |
分析 A.依据浓硫酸的吸水性解答;
B.氢氟酸能与玻璃中的二氧化硅反应;
C.氯水的次氯酸具有不稳定性,见光分解;
D.氢氧化钠能够与玻璃中二氧化硅反应生成具有粘性的硅酸钠溶液.
解答 解:A.浓硫酸具有吸水性,所以浓硫酸密封保存,故A正确;
B.氢氟酸能与玻璃中的二氧化硅反应,所以不能用玻璃瓶盛放HF,故B错误;
C.氯水的次氯酸具有不稳定性,见光分解,所以新制氯水保存在棕色试剂瓶中,故C正确;
D.氢氧化钠能够与玻璃中二氧化硅反应生成具有粘性的硅酸钠溶液,为防止瓶塞与玻璃瓶粘到一起,所以不能用磨口玻璃塞盛放氢氧化钠溶液,故D正确;
故选:B.
点评 本题考查化学试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用 KIO3氧化酸性溶液中的 KI:5I-+IO3-+3H2O═3I26OH- | |
| B. | 向(NH4)2Fe(SO4)2稀溶液中加一定量NaOH 溶液:NH++2Fe2++5OH-═NH3•H2O+2Fe(OH)2↓ | |
| C. | 向氯化铝溶液中滴入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 将少量SO2通入NaClO溶液:SO2+H2O+2ClO-═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2mol•L-1的 Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] | |
| B. | 浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a>b>c | |
| C. | NaHSO3溶液显酸性,c(Na+)>c(HSO3- )>c(H+)>c(OH-)>c(SO32-) | |
| D. | pH=3.6 的0.lmol/LHX 与0.lmol/LNaX 的混合溶液中,2c(H+)-2c(OH-)=c(X-)-c(HX) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
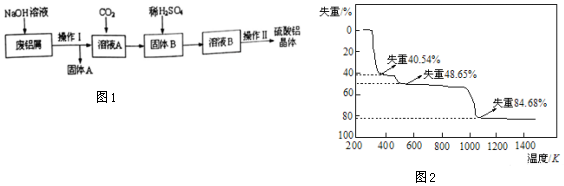
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-) | |
| B. | pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1HCl溶液与0.2 mol•L-1 NH3•H2O溶液等体积混合pH>7:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 0.1mol•L-1K2C2O4溶液与0.2 mol•L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.6g | B. | 8.32g | C. | 2.6g | D. | 3.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com