
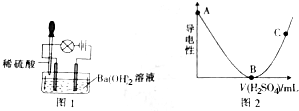
分析 (1)NaHSO4在水溶液中电离出钠离子和氢离子、硫酸根离子,据此回答;
(2)H2SO4和Ba(OH)2反应会出现白色沉淀,据此回答;
(3)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子,再加硫酸时,溶液中自由离子浓度又开始逐渐增大;
(4)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,据此回答.
解答 解:(1)NaHSO4在水溶液中电离出钠离子和氢离子、硫酸根离子,属于盐中的钠盐,也可是说是含氧酸盐,酸式盐,故选AC.
(2)H2SO4和Ba(OH)2反应会出现白色沉淀,故答案为:出现白色沉淀;
(3)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子,出现亮→暗→熄的现象,再加硫酸时,溶液中自由离子浓度又开始逐渐增大;故答案为:硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,使溶液中自由离子浓度逐渐减小,直到反应完全,溶液中几乎没有自由离子;加硫酸时,溶液中自由离子浓度又开始逐渐增大.
(4)硫酸和氢氧化钡之间反应生成难电离的硫酸钡和水,发生反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
点评 本题考查离子反应及导电性实验,注意发生的离子反应及溶液中离子浓度与导电性的关系即可解答,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)=CO2(g)△H=+110.5 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
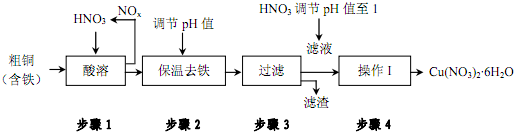
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
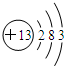 .
.| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
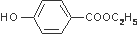 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):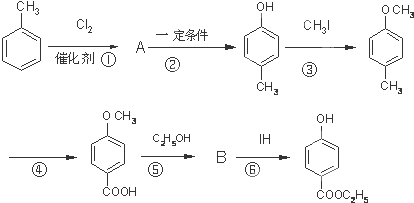
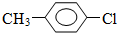 .
. +CH3I→
+CH3I→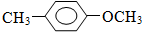 +HI
+HI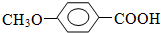 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$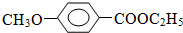 C2H5OH+H2O
C2H5OH+H2O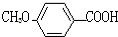 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式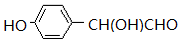 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com