
【题目】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |
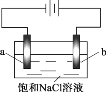
下列分析不正确的是
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH =NaCl+NaClO+H2O
C. 电解时OH- 由b极向a极移动
D. 不宜采用实验③的电压制备NaClO
【答案】C
【解析】
用惰性电极电解饱和食盐水,电解的总方程式是:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,阳极发生氧化反应,阴极发生还原反应,溶液中阳离子向阴极定向移动,阴离子向阳极定向移动,据此分析。
Cl2↑+H2↑+2NaOH,阳极发生氧化反应,阴极发生还原反应,溶液中阳离子向阴极定向移动,阴离子向阳极定向移动,据此分析。
A.根据图示可知a电极为阴极,溶液中的阳离子H+在阴极上获得电子,发生还原反应,A正确;
B.在a电极溶液中的H+获得电子,变为H2逸出,附近溶液中OH-增多阴极产生NaOH,在阳极b电极上溶液中阴离子Cl-失去电子变为Cl2,Cl2与溶液中的NaOH发生反应:Cl2+2NaOH =NaCl+NaClO+H2O,B正确;
C.电解时阴离子OH- 向正电荷较多的阳极移动,即会由a极向b极移动,C错误;
D.实验③电压高,电流大,反应速率快,反应产生的氯气未能与NaOH溶液反应,就会从溶液中逸出,所以不能采用该电压制备NaClO,D正确;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体
B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2
D.N4的摩尔质量是56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.小苏打用于治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
B.铜与浓硝酸反应:Cu+3HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=Cu2++2Fe2+
D.向漂白液中通入SO2提高漂白效率:ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐。服用维生素C,有利于人体对铁元素的吸收。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作 用下转化成亚铁盐。此反应的离子方程式______。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
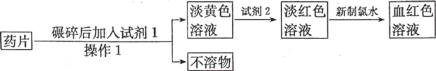
①操作1的名称是__________。
②试剂2为______溶液(填化学式)。
③加入新制氯水,溶液中发生反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )
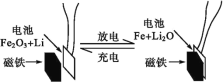
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电完成后,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
A.2 min 末时 A 和 B 的浓度之比为 5∶3
B.x=1
C.2 min 末时 A 消耗的浓度为 0.5 mol·L-1
D.2 min 末时 B 的浓度为 1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+Br2=2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2molL-1 B. 1molL-1 C. 0.4molL-1 D. 0.2molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com