
甲装置中所含的是物质的量之比为1∶2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是

A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.BC段阴极产物和阳极产物的体积之比为2∶1
C.AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
某溶液中可能含有OH-、CO32- 、AlO2-、 SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是
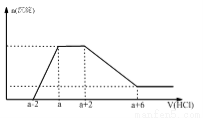
A.原溶液一定含有硫酸钠
B.反应最后形成的溶液中的溶质为氯化钠
C.原溶液中一定含有的阴离子有OH-、CO32- 、AlO2-、 SiO32-
D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南二校高一理科实验班上联考2化学卷(解析版) 题型:填空题
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。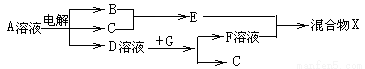
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列有关环境污染的叙述错误的是
A.空气质量报告中的主要污染物有可吸入颗粒物、二氧化氮、二氧化硫、一氧化碳等
B.氮氧化物是形成光化学烟雾的主要原因 ,水体中氮的含量过高时会引起水体富营养化,导致藻类“疯长”迅速覆盖在水面上
,水体中氮的含量过高时会引起水体富营养化,导致藻类“疯长”迅速覆盖在水面上
C.臭氧可以杀菌消毒,空气中的臭氧含量越高,对人体健康越有利
D.酸雨通常是指pH在5.6以下的降水,二氧化硫是酸雨的主要污染源
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高二12月化学卷(解析版) 题型:填空题
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极:  。
。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:填空题
某温度(T ℃)时,测得0.01 mol·L-1 NaOH溶液的pH=11,则该温度下水的Kw=________。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合。
(1)若所得混合液为中性,且a=11,b=3,则Va∶Vb=__________。
(2)若所得混合液为中性,且Va∶Vb=10∶1,则a+b=__________。
(3)若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:实验题
在高温下,Fe与水蒸气可发生反应应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验“请回答该实验中的问题.

(1)写出该反应的化学方程式 .
(2)实验前必须对整套装置进行的操作是 ;
(3)碱石灰的作用是 ;
(4)试管中收集到的气体是 ,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行 ,检验这一操作的目的是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:填空题
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
分组实验 | 催化剂 | |
① | 10mL 5% H2O2溶液 | 无 |
② | 10mL 2% H2O2溶液 | 无 |
③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
(2)实验①和②的目的是 .实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .

(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论: .
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因: ,计算H2O2的初始物质的量浓度为 .(保留两位有效数字,在标准状况下测定)
(5)常温下H2O2溶液类似于二元弱酸溶液,H2O2的电离方程式为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省钦南区高一上学期期中质量调研化学试卷(解析版) 题型:选择题
某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合价将
A.无法确定 B.升高 C.不变 D.降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com