
����Ŀ��X��Y��Z��M��WΪ���ֶ�����Ԫ�ء�X��Y��Z��ԭ���������ε�����ͬ����Ԫ�أ�������������֮��Ϊ15��X��Z���γ�XZ2���ӣ�Y��M�γɵ���̬�������Ħ������Ϊ17g/mol��W����������X��Y��Z��M����Ԫ��������֮�͵�![]() ������˵����ȷ����
������˵����ȷ����
A.XZ2��M2Z2��Ϊ���ۻ�����
B.ԭ�Ӱ뾶��W>Z>Y>X>M
C.��XԪ���γɵĵ���Ӳ��һ���ܴ�
D.��X��Y��Z��M����Ԫ���γɵĻ�����ֻ�������Ӽ�
���𰸡�A
��������
X��Y��Z��ԭ���������ε�����ͬ����Ԫ�أ�������������֮��Ϊ15����X��Y��Z�������������ֱ�Ϊ4��5��6��ԭ�������ֱ�Ϊ6��7��8���Ӷ�ȷ�����Ƿֱ�ΪC��N��OԪ�أ�Y��M�γɵ���̬�������Ħ������Ϊ17g/mol����MΪ��(H)Ԫ�أ�W����������X��Y��Z��M����Ԫ��������֮�͵�![]() ������������Ϊ
������������Ϊ![]() ��(1+6+7+8)=11���Ӷ�ȷ����Ϊ��(Na)��
��(1+6+7+8)=11���Ӷ�ȷ����Ϊ��(Na)��
A��XZ2��M2Z2�ֱ�ΪCO2��H2O2�����߾�Ϊ���ۻ����A��ȷ��
B��ԭ�Ӱ뾶��Na>C>N>O>H��B����ȷ��
C����XԪ���γɵĵ���ʯī��Ӳ�Ⱥ�С��C����ȷ��
D����X��Y��Z��M����Ԫ���γɵĻ�����NH4HCO3�У��Ⱥ������Ӽ��ֺ��й��ۼ���D����ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����й�ء����ʵ�˵������ȷ����
A. �к͵��������Ũ�ȵİ�ˮ������������Һ��pH����7��ǰ�����ĵ������
B. ��NaHS ��Һ�м������� KOH ��c(Na+)=c(H2S)+c(HS-)+c(S2-)
C. ��amol��L-1�Ĵ�����0.01 mol��L-1������������Һ�������ϣ���Һ�У�c(Na+)=c(CH3COO-)������ĵ��볣��Ka=![]() (�ú�a�Ĵ���ʽ��ʾ��
(�ú�a�Ĵ���ʽ��ʾ��
D. ��NH4Cl��Һ�м���������Ũ�ȵ�ϡ���ᣬ�� ��ֵ��С
��ֵ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ʽΪC12H26��ij��������Ϊ��2��4��������3��5�����һ�����������һͬѧ��Ϊ���������д������йظ�������˵��������Ϊ��ȷ����
A. ���������ɵ�ϩ���������ӳɶ�������ԭ��ϩ������11�ֲ�ͬ�ṹ
B. ��������һ�ȴ�����10��
C. ��������ȷ����ӦΪ2��4��5��������3���һ�����
D. �����������к���5��֧��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�⻯�����ж��֣������ڹ�ҵ����������������Ҫ��;��
��1����ҵ�Ͽ��ɶ�ϩ(C4H8)���Ʊ���ϩ(C3H6)����ϩ(C2H4)������Ҫ��Ӧԭ��Ϊ��
��ӦI��C4H8 (g) ![]()
![]() C3H6(g) ��H1
C3H6(g) ��H1
��ӦII��C4H8(g) ![]() 2C2H4 (g) ��H2
2C2H4 (g) ��H2
����֪�����ѽ������ȷ�Ӧ������H1________��H2������>���� ��=������<������
����ij�¶��·�Ӧ�ﵽƽ��ʱC4H8��C3H6��C2H4����������ֱ�Ϊ20%��70%��10%��ƽ��ʱ��ѹǿΪP���������¶��·�ӦII��ƽ�ⳣ��Kp=________��KpΪ������ķ�ѹ��ʾ��ƽ�ⳣ������ѹ=����������������ϵ��ѹ��
��2��ʯ��Σ���ս����أ������ת������������Ȼ��������ҵ�зdz���Ҫ�����á���������������Ҫ�����ü��������ԭ�����Ʊ��ϳ���(CO��H2�������)�����ڳ��������������м���-ˮ��������������-������̼�������䷴Ӧ�ֱ�Ϊ:
CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ��H>0
CO(g) + 3H2(g) ��H>0
CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
����ͼΪ��ӦѹǿΪ0.3 MPa��Ͷ�ϱ�n(H2O)/n(CH4)Ϊ1�������ֲ�ͬ�����������£�����-ˮ����������Ӧ��CH4ת�������¶ȱ仯�Ĺ�ϵ��
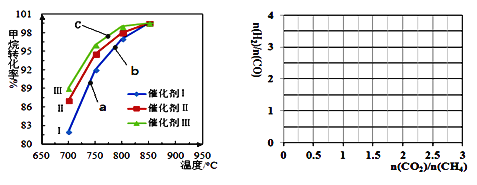
����˵����ȷ����________��
A ����ͬ�����£����ִ�����Ĵ�Ч���ɸߵ��͵�˳���Ǣ�
B b��CH4��ת���ʸ���a�㣬ԭ����b��a�����δ�ﵽƽ��״̬��b���¶ȸߣ���Ӧ���ʽϿ죬��CH4��ת���ʽϴ�
C C��һ��δ�ﵽƽ��״̬
D ����ֻ�ı䷴Ӧ���ʲ��ı�ƽ���ƶ���������850��ʱ����ͬ�������������´�ƽ��ʱCH4��ת������ͬ
�ڴ�����Ҳ���Դ�����-������̼�������ڴ�������£���Ӧ�¶�850 oC ��n(H2O)/n(CH4)Ϊ1����ϵ�У�����CO2��������Ӧ�ﵽƽ��ʱn(H2)/n(CO)�����ʱn(CO2)/n(CH4)�ı仯���ߡ�(��֪�����飭������̼������ƽ�ⳣ��>>����-ˮ����������Ӧ��ƽ�ⳣ��)________ ��
��3��������������������������Һ��ͬʱ�õ������ԭ������ͼ��ʾ��ͼ����HA����ʾ������ӣ�A����ʾ��������ӣ���
�������ĵ缫��ӦʽΪ________��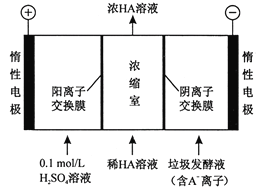
�ڵ������У���ȡһ���Ĵ�ʩ�ɿ��������ҵ�pHԼΪ6��8����ʱ����Ũ���ҵ�OH���ɺ��Բ��ơ�400 mL10 g/L ������Һͨ��һ��ʱ���Ũ������Ϊ 145 g/L(��Һ����仯���Բ���)���������ϲ�����H2�ڱ�״���µ����ԼΪ________L��(�����Ħ������Ϊ90g/ mol ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��B��C���������У���A��B��X����X��C����Ӧ�����������仯��ͼ��ʾ��E1��ʾ��ӦA��B��X�Ļ�ܡ������й�������ȷ����
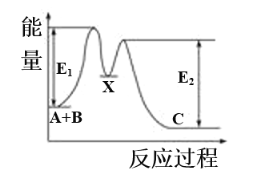
A. X�Ƿ�ӦA��B��C�Ĵ���
B. ��ӦA��B��C����H<0
C. E2��ʾ��ӦX��C�Ļ��
D. ��������ɸı䷴ӦA��B��C���ʱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���OH-��CO32-��A1O2-��SiO32-��SO42-��HCO3-��Na+��Fe3+��Mg2+��Al3+�����ӡ��������Һ����μ���һ�����ʵ���Ũ�ȵ�������Һʱ���������ɳ��������ʵ�����������Һ������仯����ͼ��ʾ������˵����ȷ����
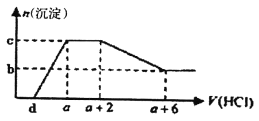
A. ԭ��Һ�п��ܺ���Na2SO4�����ܲ�����CO32-
B. ԭ��Һ��һ�����е�������ֻ��:OH-��A1O2-��CO32-
C. ԭ��Һ�к�CO32-��A1O2-�����ʵ���֮��Ϊ3:4
D. a-d>3/4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾװ�ý���ʵ�飬��Ӧ�����㹻��ʱ���װ��II��ʵ��������ȷ����
�� | �� | �� | II��ʵ������ |
| |
A | Ũ���� | ̼��� | ���з�̪��ϡ̼������Һ | ��Һ�ɺ�ɫ��Ϊdz��ɫ | |
B | Ũ��ˮ | ������ | ����������Һ | ����������ɫ���� | |
C | ������ | �Ҵ���Ũ���� | ����̼������Һ | ��Һ�ֲ㣬�ϲ�Ϊ��״Һ�� | |
D | NH4Cl��Һ | NaAlO2��Һ | ��ɫʯ����Һ | ��Һ����ɫ��Ϊ��ɫ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 mol��L-1��KI��Һ��0.05 mol��L-1Fe2(SO4)3��Һ�������Ϻ�ȡ���Һ�ֱ��������ʵ�飬��˵����Һ�д��ڻ�ѧƽ����2Fe3++2I��![]() 2Fe2++I2������
2Fe2++I2������
ʵ���� | ʵ����� | ʵ������ |
�� | ����KSCN��Һ | ��Һ���ɫ |
�� | ����AgNO3��Һ | �л�ɫ�������� |
�� | ����K3[Fe(CN)6]��Һ | ����ɫ�������� |
�� | ���������Һ | ��Һ����ɫ |
A. ������ B. ������ C. ������ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���õ����ز�����ͭ��װ��ͼ��ʾ�˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4������˵������ȷ����

A. �ù����ǽ�̫����ת��Ϊ��ѧ�ܵĹ���
B. GaN���淢��������Ӧ��2H2O��4 e��=== O2����4H��
C. Cu����ķ�Ӧ�ǣ�CO2��8e����6H2O === CH4��8OH
D. H+�����ӽ���Ĥ��������Ǩ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com