
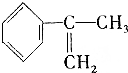
 、液溴、浓硫酸和其他无机试剂,请用5个化学方程式表示下列转化过程:
、液溴、浓硫酸和其他无机试剂,请用5个化学方程式表示下列转化过程: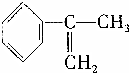 →
→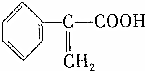
 ;
;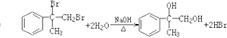 ;
; ;
; ;
;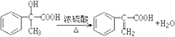 .
.  天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
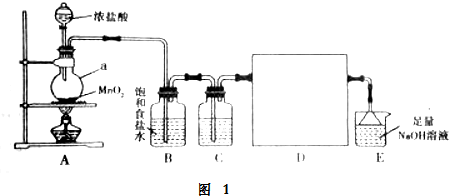
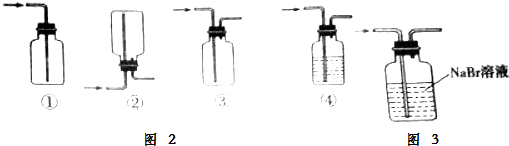
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用于制作集成电路板的酚醛树脂是天然高分子化合物 | |
| B. | 食盐、食醋、食用油均可用作食品添加剂,都属于有机物 | |
| C. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n=$\frac{{M}_{2}-2{M}_{1}}{58}$ | B. | n=$\frac{{M}_{2}-{M}_{1}}{29}$ | C. | n=$\frac{2{M}_{2}-{M}_{1}}{58}$ | D. | n=$\frac{{M}_{2}-{M}_{1}}{58}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O | |
| B. | 苯酚钠溶液通入少量CO2:2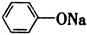 +CO2+H2O→2 +CO2+H2O→2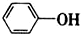 +Na2CO3 +Na2CO3 | |
| C. | 乙酸苯酚酯在足量的NaOH溶液中水解: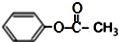 +NaOH→CH3COONa+ +NaOH→CH3COONa+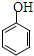 | |
| D. | 工业制聚乙烯:nCH2=CH2 $\stackrel{催化剂}{→}$ |
查看答案和解析>>
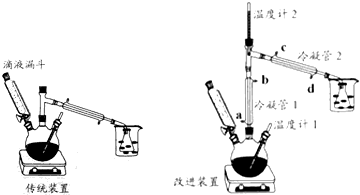
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com