工业上采用乙苯与CO
2脱氢生产重要化工原料苯乙烯

其中乙苯在CO
2气氛中的反应可分两步进行
A

B

(1)上述乙苯与CO
2反应的反应热△H为
-166KJ/mol
-166KJ/mol
(2)①乙苯与CO
2反应的平衡常数表达式为:K=
| c(C6H5CH=CH2)?c(CO)?c(H2O) |
| c(C6H5CH2CH3)c(CO2) |
| c(C6H5CH=CH2)?c(CO)?c(H2O) |
| c(C6H5CH2CH3)c(CO2) |
②乙苯与CO
2在固定体积的容器中反应下列叙述不能说明已达到平衡状态的是
acd
acd
a.体系的密度不再改变 b.体系的压强不再改变 c.c(CO
2)=c(CO)
d.消耗1molCO
2同时生成1molH
2O e.CO
2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO
2的反应在三种不同的条件下进行实验,乙苯、CO
2的起始浓度分别为
1.0mol/L和3.0mol/L,其中实验I在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示.

①实验I乙苯在0-50min时的反应速率为
0.012mol/(L?min)
0.012mol/(L?min)
②实验Ⅱ可能改变条件的是
加催化剂
加催化剂
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将
减小
减小
(填“增大”、“减小”或“不变”),计算此时平衡常数为
0.225
0.225
.



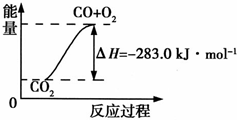 已知:①CO(g)+
已知:①CO(g)+ 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究其反应原理,现进行如下实验,在体积为2L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2 (g)+3H2 (g)
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究其反应原理,现进行如下实验,在体积为2L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2 (g)+3H2 (g) CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示,下列说法正确的是( )
CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示,下列说法正确的是( )


