
| A. | 蒸馏 | B. | 重结晶 | C. | 萃取 | D. | 过滤 |
科目:高中化学 来源: 题型:解答题
 △H=+88.6kJ/mol
△H=+88.6kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Cu | Cu | Zn | Al |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | Cu Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
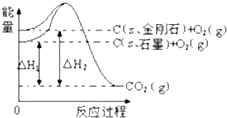
| A. | 石墨转化为金刚石需吸热 | B. | 石墨和金刚石的转化是物理变化 | ||
| C. | 金刚石的稳定性强于石墨 | D. | 石墨和金刚石是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com