
分析 (1)根据化学反应方程式,将氢氧化钠的量代入计算来求收集到标准状况下的氢气;
(2)先利用化学反应方程式,将食盐的质量代入计算氯气的质量,再进一步计算生成盐酸的质量;
(3)先利用化学反应方程式,将计算生成氢氧化钠的质量,氢气和氯气的质量,注意总质量应为减去氢气和氯气的质量.
解答 解:(1)电解池的阳极上是氯离子失电子产生氯气,阴极上是氢离子得电子生成氢气,电解氯化钠溶液的原理方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,产生0.2mol NaOH时,则生成0.1mol氢气,所以能收集到标准状况下的H22.24L;
故答案为:2.24L;
(2)电解氯化钠溶液的原理方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,电解585t食盐,则生成氯气物质的量为$\frac{585×10{\;}^{6}}{58.5}$×$\frac{1}{2}$=5×106mol,
氯气80%用于生产盐酸,可得到质量分数为36.5%的盐酸为$\frac{5×10{\;}^{6}mol×80%×2×36.5g/mol}{36.5%}$=800t,
故答案为:800;
(3)电解氯化钠溶液的原理方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,所以取200g溶质质量分数为0.265饱和食盐水进行电解,当NaCl反应了一半时,则消耗氯化钠为$\frac{200×0.265×0.5}{58.5}$=0.453mol,所以生成氢氧化钠的质量为0.453mol×40g/mol=18.12g,放出氢气和氯气共0.453×0.5×71+0.453×0.5×2=16.534g,则NaOH的质量分数为$\frac{18.12}{200-16.534}$=0.099,NaCl的质量分数为$\frac{200×0.265×0.5}{200-16.534}$=0.144,
答:所得溶液中NaOH的质量分数为0.099,NaCl的质量分数为0.144.
点评 本题考查学生电解氯化钠溶液的基本工作原理知识,注意知识的积累是解题的关键,难度不大,注意(3)总质量应为减去氢气和氯气的质量.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
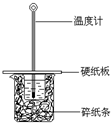 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法中,正确的是( )| A. | 实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若将盐酸体积改为60 mL,理论上所求中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应都是置换反应 | B. | 据反应条件无法判断反应是否吸热 | ||
| C. | 两个反应互为可逆反应 | D. | 两个反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g | B. | 6.2g | C. | 7.8g | D. | 9.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄砷的熔点高于白磷 | B. | 黄砷中共价键键能大于白磷 | ||
| C. | 黄砷分子极性大于白磷 | D. | 分子中共价键键角均为109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A-m-n | B. | A-m+n | C. | A-n+m | D. | A+n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属卤族元素 | B. | 属第17族元素 | C. | 属非金属元素 | D. | 有放射性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com