
����Ŀ����������NOx����ҪָNO��NO2�����γ����ꡢ�⻯ѧ�������ƻ������㣬�Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
(1)�о����������������ڴ����к������ӵ������ʱ���漰���·�Ӧ:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)��K1����H1<0��(��)
NaNO3(s)+ClNO(g)��K1����H1<0��(��)
2NO(g)+Cl2(g)![]() 2ClNO(g)��K2����H2<0��(��)
2ClNO(g)��K2����H2<0��(��)
��4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)��ƽ�ⳣ��K=____(��K1��K2��ʾ)��
2NaNO3(s)+2NO(g)+Cl2(g)��ƽ�ⳣ��K=____(��K1��K2��ʾ)��
��Ϊ�о���ͬ�����Է�Ӧ(��)��Ӱ�죬�ں��������£���2 L�����ܱ������м���0.2 mol NO��0.1 mol Cl2��10 minʱ��Ӧ(��)�ﵽƽ�⡣���10 min����(ClNO)=7.5��10-3mol��L-1��min-1����ƽ���NO��ת������1=____�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У�ƽ��ʱNO��ת������2____��1(����>����<������=��)��ƽ�ⳣ��K2____(��������������С������������)��
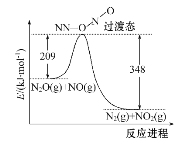
(2)NO����N2O��Ӧ����N2��NO2����Ӧ�������仯����ͼ��ʾ��������1 mol N2���䦤H=____kJ��mol-1��
(3)NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������Ӧԭ����ͼ����ʾ��
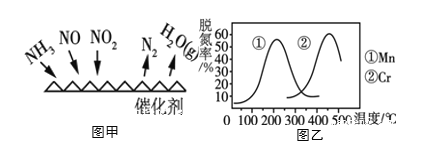
����ͼ��֪��SCR�����е�������Ϊ_____________����NO2��NO�����ʵ���֮��Ϊ1:1ʱ��������������һ�������·����ѵ���Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��ͼ���Dz�ͬ����Mn��Cr�ڲ�ͬ�¶��¶�Ӧ���ѵ��ʣ���ͼ��֪��ҵѡȡ����Ѵ���Ϊ________��
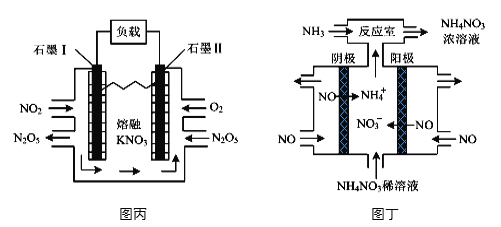
(4)���õ绯ѧװ�ÿ���������������Ⱦ�����Ϊ����ͼ��װ��ʵ�ֵ�����ת����ʽ��_______��ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã���װ���������ĵ缫��ӦʽΪ___________________��
���𰸡�K12/K2 75% > ���� -139 NO2��NO 2NH3��NO2��NO![]() 2N2��3H2O Mn ��ѧ��ת��Ϊ���� NO��3e����2H2O=NO3����4H+
2N2��3H2O Mn ��ѧ��ת��Ϊ���� NO��3e����2H2O=NO3����4H+
��������
(1)����֪��(��)2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)��K1 ��H1��0��(��)2NO(g)+Cl2(g)2ClNO(g)��K2 ��H2��0�����ݸ�˹���ɢ���2-��ɵã�
�ڸ������ĵ�c(NO)=���ɵ�c(ClNO)�������ĵ�c(NO)�����ת����=![]() ��100%�ɵã����ں�ѹ�����½��У����ݷ�Ӧ���ص㣬����ں����൱������ѹǿ��
��100%�ɵã����ں�ѹ�����½��У����ݷ�Ӧ���ص㣬����ں����൱������ѹǿ��
(2)����ͼ1molN2O(g)��1molNO(g)������̬����209kJ�������ù���̬����1molN2(g)��1molNO2(g)�ų�����348kJ��д���Ȼ�ѧ����ʽ�ɵã�
(3)�ٸ����������õ�����Ԫ�ػ��ϼ۽��ͷ����ɵã���ϵ�ʧ�����غ���д����ʽ��
��ѡ�������Ҫ���¶ȵͣ������õģ�
(4)ͼ��Ϊԭ���װ�ã�ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã�����ʧȥ���ӷ���������Ӧ��Ԫ�ػ��ϼ����ߣ�������Ի�����д�ɵá�
(1)����֪��(��)2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)��K1 ��H1��0��(��)2NO(g)+Cl2(g)2ClNO(g)��K2 ��H2��0�����ݸ�˹���ɢ���2-��ɵ�4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)������ƽ�ⳣ��K=![]() ��
��
�ڲ��10 min����(ClNO)=7.5��10-3molL-1min-1����10min�����ɵ�c(ClNO)=7.5��10-2molL-1�����ĵ�c(NO)=7.5��10-2molL-1����ƽ���NO��ת������1=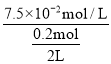 ��100%=75%�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У��÷�Ӧ������ӦΪ���������С�ķ�Ӧ�����ѹ����������ں���ѹǿ��ƽ�������ƶ������ѹ������NO��ƽ��ת���ʽϺ��ݴ���2����1����ѧƽ�ⳣ�����¶���أ��¶Ȳ��䣬K���䣬��K2���䣻
��100%=75%�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½��У��÷�Ӧ������ӦΪ���������С�ķ�Ӧ�����ѹ����������ں���ѹǿ��ƽ�������ƶ������ѹ������NO��ƽ��ת���ʽϺ��ݴ���2����1����ѧƽ�ⳣ�����¶���أ��¶Ȳ��䣬K���䣬��K2���䣻
(2)�������֪��1molN2O(g)��1molNO(g)������̬����209kJ�������ù���̬����1molN2(g)��1molNO2(g)�ų�����348kJ���ɵ��Ȼ�ѧ����ʽ��N2O(g)+NO(g)=N2(g)+NO2(g)��H=-139kJmol-1��
(3)����ͼ����֪��SCR������NH3��NO��NO2��Ӧ����ΪN2��ˮ��NO��NO2��NԪ�ػ��ϼ۽��ͣ���������ΪNO��NO2���ѵ�Ч�����ʱn(NO2)��n(NO)=1��1����Ӧ�Ļ�ѧ����ʽΪ��2NH3+NO2+NO![]() 2N2+3H2O��
2N2+3H2O��
�ڸ���ͼ��֪Mn����ʱ��200�������ѵ�����ߣ�Cr��������500�������ѵ�����ߣ������ߵ�����ѵ��ʲ�࣬ʹ��Mn��������Ҫ���¶ȵͣ������ã����ʹ�õ���ѵĴ���ΪMn��
(4)ͼ��Ϊԭ���װ�ã�����ת����ʽΪ����ѧ��ת��Ϊ���ܣ�ͼ��Ϊ���NO�Ʊ�NH4NO3��װ�ã�����ʧȥ���ӷ���������Ӧ��Ԫ�ػ��ϼ����ߣ���ΪNO�ŵ�����NO3-���缫��ӦΪ��NO-3e-+2H2O=NO3-+4H+��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Fe[Fe(CN)6]Ϊ���������Ϳɳ�������ӵ�أ���ŵ繤��ԭ����ͼ��ʾ������˵����ȷ����

A. �ŵ�ʱ��Mo���ϵĵ��Ʊ�Mg���ϵĵ�
B. ���ʱ��Mo���ӵ�Դ�ĸ���
C. �ŵ�ʱ��������ӦΪFe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. ���ʱ�����·��ͨ��0.2mol����ʱ��������������3.55g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��H��Ϊ��ѧ��ѧ�г��������ʣ�A��B��HΪ���壬��Ӧ������Ҫ�Ĺ�ҵ��Ӧ������֮��������ת����ϵ(��Ӧ�����ɵ�ˮ����ȥ)��

��ش��������⣺
��1��B��_____��D��_____��G��_____��H��_____(�ѧʽ)��
��2����ҵ�ϳ����÷�Ӧ����ȡƯ�ۣ��÷�Ӧ�Ļ�ѧ����ʽ��__________��Ư������ˮ���ܿ����е�CO2���ã���������Ư�ס�ɱ�����õĴ����ᣬ��ѧ��Ӧ����ʽΪ_________��
��3��A��Ԫ�ص�ԭ�ӽṹʾ��ͼΪ________��
��4��F����Һ�еĵ��뷽��ʽΪ_________��
��5��������Ӧ������������ԭ��Ӧ����_______(��д���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������д������
A. ﮡ��ơ��ظ�1 g���ֱ���������ˮ��Ӧ������ҵ����
B. ﮡ��ơ��ظ�1 g���ֱ���������ˮ��Ӧ���������������������
C. ﮡ��ơ��ظ�1 g����������ԭ�����������
D. ﮡ��ơ���ʧ����������ǿ���Ǽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���ͺ����к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
ij��ѧ��ȤС�齫�������̢�������Ƴ�����ͼ��ʾ������

��֪���̢ڷ�����Ӧ�Ļ�ѧ����ʽΪCl2��2KI===2KCl��I2
�ش��������⣺
��1��д����ȡ���̢�������ʵ����������ƣ���____________����____________��
��2�������չ����У�ʹ�õ���ʵ�������оƾ��ơ�____________��____________(����������)��
��3��F���²�Һ�����ɫΪ________ɫ���ϲ�Һ�������ʵ���Ҫ�ɷ�Ϊ____________��
��4����F�еõ���̬�����еIJ�����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̼�ܵ����Ƴɹ������˿Ƽ��Ľ������õ绡���ϳɵ�����̼�ܳ����д���������̼������������̼���������������������ᴿ���˷�Ӧ�еķ�Ӧ�����������C��CO2��H2SO4��K2Cr2O7��Cr2(SO4)3��K2SO4��H2O�������ʡ�
(1)����̼��������ɢ��һ���ܼ��У��γ��ȶ��ķ�ɢϵ���������е�������__________��
�ٶ����ЧӦ���ڼ��뱥��(NH4)2SO4��Һ�����۳����ۿ�ͨ����Ĥ
(2)��������������գ�����ƽ��ѧ����ʽ��____C��____��____H2SO4��____K2SO4��________��____Cr2(SO4)3��____H2O��
(3)H2SO4��������Ӧ�б��ֳ�����������________(��ѡ����)��
A�������� B�������Ժ�����
C������ D����ԭ�Ժ�����
(4)����Ӧ�е���ת����0.8 mol��������������ڱ�״���µ����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һѧ�������ͼ��ʾװ�ý���NaHCO3�ķֽ⣬��֤ʵ��������CO2������
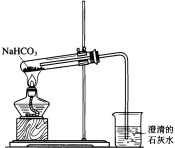
��1���Թ��з����Ļ�ѧ��Ӧ����ʽ��____________________________��
��2��ָ����ѧ����Ƶ�װ��ͼ�Ĵ���֮����������������˵�����ɣ�������2����____________��
��3���ձ��з�����Ӧ�����ӷ���ʽ��_______________________________��
��4�������16.8gNaHCO3����һ��ʱ�䣬Ȼ��ʣ���������ˮ��������������CaCl2��Һ�����յõ���ɫ����5.0g����NaHCO3�ֽ�ٷ���Ϊ______________����CaCl2��Ӧ�����ӷ���ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���в��ֺ����л���ѭ����ͼ1��ʾ��
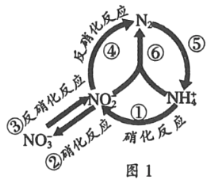
��1��ͼ�����ڵ��Ĺ̶�����____��������ţ���
��2��ͼ�Т٢ڵ�ת������������ϸ��������ϸ�������½��еģ���֪��
2NH4+��aq��+3O2�T2NO2����aq��+4H+��aq��+2H2O��l����H1����556.8kJ/mol
2NO2����aq��+O2��g����2NO3����aq������H2����145.2kJmol��1
��ӦNH4+��aq��+2O2��g����NO3����aq��+2H+��aq��+H2O��1����H3��____kJmol��1
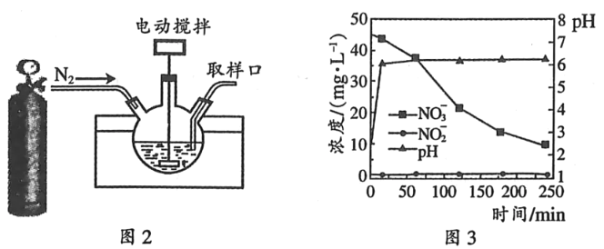
��3��ij���л����о�ͨ����ѧ�������ķ�������ˮ���й�����NO3����������ͼʾ��������ƿ�У�װ����ͼ2���У�����NO3����ʼŨ��Ϊ45mgL��1��ˮ�������Ƶ��������ۣ���ʼʱpH��2.5������ˮԡ�¶�Ϊ25�桢��������Ϊ500ת/�֣�ʵ����ÿ���һ��ʱ���ȡ���ڼ��ˮ����NO3����NO2����pH��NH4+��N2δ��⣩��������ݣ���ͼ3����
��ʵ���ҿ�ͨ����ӦFe��H2O��62++2BH4����Fe��+2H3BO3+7H2���Ʊ��������ۣ�ÿ����1molFeת�Ƶ����ܵ����ʵ���Ϊ____��
����������ƿ��ͨ��N2��Ŀ����____��
�ۿ�ʼ��Ӧ0��20min��pH�������ߵ�Լ6.2��ԭ��֮һ��___________��NO3����ԭΪNH4+��������20��250minʱ�����뻺����Һά��pH6.2���ң�NO3����Ҫ��ԭΪNH4+��Feת��ΪFe��OH��2���÷�Ӧ�����ӷ���ʽΪ___
��4��һ�ֿ��Խ���ˮ����NO3�������ķ����ǣ��ڷ�ˮ�м���ʳ�κ�������缫���е�ⷴ�����ѳ���ԭ������ͼ4��Ҫ˵����
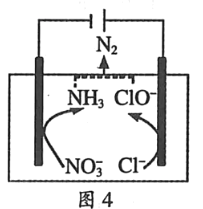
�ٵ��ʱ�������ĵ缫��ӦʽΪ_____��
����Һ���ݳ�N2�����ӷ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(ij�������к�������[KAl(SO4)2��12H2O]��Al2O3��Fe2O3����һ���������ɼ�ʵ����ͼ��ʾ������֮���ת����

��ش��������⣺
��1��д��A��B�Ļ�ѧʽ��A___��B___��
��2���Լ�a���ѡ�������Լ��е���______��
A.NaOH��Һ B.ϡ���� C.������̼ D.��ˮ
д����Ӧ�����ӷ���ʽ___��
��3��д����Ӧ�ڣ�������ҺC�ͳ����������ӷ���ʽ___��
��4������D������Ϊ�����ԵĻ�ѧ���ϣ�D���������ʵĻ�ѧʽΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com