
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | 1 | —— | ——- | -3 | -2 |
已知,X、Y、Z和M下列说法正确的是
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,Y最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
X2、Y2单质在一定条件下有如下反应:X2+Y2+H2O→HXO3+HY(未配平)。
按要求回答下列问题:
(1)X2、Y2可能的组合是__________________。
a.F2、Br2 b.I2、Cl2 c.C12、O2 d.Br2、N2
(2)试比较X2、Y2、HXO3的氧化性强弱:___________________[用(1)中所选的X2、Y2回答,下同]。判断HXO3+HX能否反应:___________(填“能”或“不能”)。若能反应,请写出其化学反应方程式,若不能反应,请说明理由:____________________。
(3)若用KX制取HX,不能选用浓硫酸的原因是________________________。(用化学方程式表示)
(4)工业上测定某产品中YO-的含量,先将一定量产品的溶液加入过量的KX溶液和稀硫酸中,使之反应生成X2,试写出上述反应的离子方程式:______________________。
(5)Fe2+、Fe3+、X2、X-、Y-五种微粒中的两种微粒A(阳离子)和B在溶液中能相互反应生成X2,向含微粒A的溶液中滴入足量l mol/LNa2S溶液,生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D再与稀硫酸完全反应生成E溶液。则生成的沉淀C的成份是(填化学式)____________________。E溶液中阳离子除H+外,另外的阳离子的检验方法是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子是以碳原子为中心的正四面体形结构,而不是正方形的平面结构,以下事实可作为论据的是
A.CH3Cl只有一种结构 B.CH2Cl2只有一种结构
C.CHCl3只有一种结构 D.CH4只有一种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E是元素周期表中半径最小的元素。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,
相同条件下两者在水中的溶解度较大的是 (写分子式).
(3)Q的元素核外价层电子排布式为 .
(4)XE2中X原子的杂化方式为 ;Y与E形成的化合物种类很多,其中有一种化合物分子中有6个原子,且6个原子共平面,该化合物名称为 。
(5)在Y2E6Z中存在 种结构,写出其中一种具有对称结构的结构式
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是 ( )
A.离子键被破坏的变化一定是化学变化。
B.含有金属阳离子的晶体中一定有阴离子
C.分子晶体中分子间作用力越大,分子越稳定
D.NaCl熔化时离子键被破坏,冰熔化时分子中共价键没有断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1 g样品),请回答每个方案中的问题。
[方案I]选用重量法进行测定:可用下图中的装置进行实验。

(1)A装置中NaOH溶液的作用是__________ _______,若直接向试样溶液中鼓人空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)
(2)该方案需直接测定的物理量是 。
[方案II]选用滴定法进行测定:
 (3)称取m1 g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
(3)称取m1 g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
[方案III]选用气体体积法进行测定:可用右图中的装置进行实验。
(4)为了减小实验误差,量气管中加入的液体X为
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是_________
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的水面高于量气管的水面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案IV]其操作流程如下:
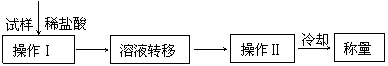
(6)操作Ⅱ的名称是________________________
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是 ,
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果_________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是( )
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com