
 和
和  D、35Cl和37Cl
D、35Cl和37Cl
分析 (1)质子数相同质量数(或中子数)不同的原子互称同位素;同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;同种元素形成的不同单质互为同素异形体;具有相同分子式而结构不同的化合物互为同分异构体;
(2)A、MgCl2为离子化合物,只含有离子键;
B、金刚石为原子晶体,存在共价键,熔化时需要破坏共价键,熔点高;
C、NH4Cl为离子化合物,既存在离子键又存在共价键,熔化时需要破坏离子键;
D、KNO3为离子化合物,既存在离子键又存在共价键,熔化时需要破坏离子键;
E、干冰为分子晶体,含有共价键,熔化时不需要破坏化学键,破坏的是分子间作用力;
F、单质碘晶体为分子晶体,含有共价键,熔化时不需要破坏化学键,破坏的是分子间作用力;
(3)①丙烯含有碳碳双键,可发生加聚反应生成聚丙烯;
②淀粉水解生成葡萄糖.
解答 解:(1):①35Cl和37Cl质子数都为17,中子数不同,是氯元素的不同原子,互为同位素,故答案为:D;
②CH2=CH-COOH和油酸(C17H33COOH)结构相似、通式相同,相差1个CH2原子团,互为同系物,故答案为:A;
③C60和石墨是由碳元素组成的不同单质,互为同素异形体,故答案为:B;
④ 分子式相同,结构不同,互为同分异构体,故答案为:C;
分子式相同,结构不同,互为同分异构体,故答案为:C;
⑤乙醇和乙二醇既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质,故答案为:E;
(2)A、MgCl2为离子化合物,只含有离子键;
B、金刚石为原子晶体,存在共价键,熔化时需要破坏共价键,熔点高;
C、NH4Cl为离子化合物,既存在离子键又存在共价键,熔化时需要破坏离子键;
D、KNO3为离子化合物,既存在离子键又存在共价键,熔化时需要破坏离子键;
E、干冰为分子晶体,含有共价键,熔化时不需要破坏化学键,破坏的是分子间作用力;
F、单质碘晶体为分子晶体,含有共价键,熔化时不需要破坏化学键,破坏的是分子间作用力;
熔化时不需破坏化学键的是EF,熔化时需破坏共价键的是B,熔点最高的是B,熔点最低的是E,晶体中既有离子键又有共价键的是CD,
故答案为:EF;B;B;E;CD;
(3)①丙烯含有碳碳双键,可发生加聚反应生成聚丙烯,反应的方程式为 ,故答案为:
,故答案为: ;
;
②淀粉在酸性环境下水解的最终产物是葡萄糖,化学方程式为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6,
故答案为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6.
点评 本题考查了同系物、同分异构体、同系物、同素异形体的判断、有机物的结构,题目难度中等,注意掌握同系物、同分异构体、同素异形体等概念,明确它们之间的区别,以及化学键的类型和化学方程式的书写,综合性强,但比较容易.


科目:高中化学 来源: 题型:解答题
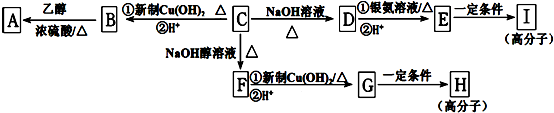
 ;
;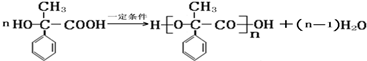 ,该反应类型是缩聚反应;
,该反应类型是缩聚反应; ,该反应类型是加聚反应;
,该反应类型是加聚反应; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
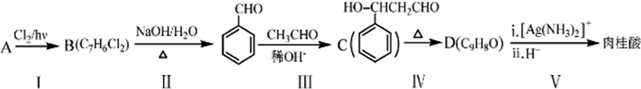

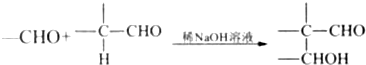
 .
. .肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是
.肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(W)<r(Z)<r(Y) | |
| C. | X的简单气态氢化物的热稳定性比W的强 | |
| D. | Z的最高价氧化物对应的水化物具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com