
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.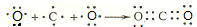 ,
,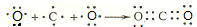 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②③混合,若有pH=7,则消耗溶液的体积:②>③ |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D、将①④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.
如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 B.
B.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com