
向蒸馏水中加入一定量的NaHSO3晶体,保持常温,测得溶液的pH=4,下列说法正确的是
| A.水电离出的H+的浓度是1.0×10-4 mol·L-1 |
| B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3) |
D
解析考点:离子浓度大小的比较;弱电解质在水溶液中的电离平衡;水的电离;盐类水解的应用.
分析:测得溶液的pH=4,说明溶液呈酸性,溶液中HSO3-离子的电离程度大于水解程度,结合弱电解质的电离和盐类的水解原理以及溶液中的电荷守恒、质子守恒、物料守恒解答该题.
解:A.测得溶液的pH=4,说明HSO3-电离出的H+的浓度是1.0×10-4mol?L-1,水电离出的H+的浓度等于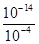 mol?L-1=1.0×10-10mol?L-1,故A错误;
mol?L-1=1.0×10-10mol?L-1,故A错误;
B.根据物料守恒可知,Na元素的物质的量与S元素的物质的量相等,则存在c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故B错误;
C.根据电荷守恒,溶液中存在c(HSO3-)+2c(SO32-)+c(OH-)=c(Na+)+c(H+),根据无聊守恒,溶液中存在c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),二者联式可得:c(H+)+c(H2SO3)-c(SO32-)=c(OH-),故C错误;
D.溶液的pH=4,说明溶液呈酸性,溶液中HSO3-离子的电离程度大于水解程度,则c(SO32-)>c(H2SO3),一般来说,弱电解质的电离程度都较小,应有c(HSO3-)>c(SO32-),则c(HSO3-)>c(SO32-)>c(H2SO3),故D正确.
故选D.


科目:高中化学 来源:松江区模拟 题型:单选题
| A.水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D.溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源:2011年上海市松江区高考化学模拟试卷(5月份)(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com