
| 2x |
| 3-x+4-3x+2x |
| 2×0.5 |
| 7-2×0.5 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
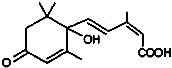 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )| A、含有碳碳双键、羟基、羰基、羧基 |
| B、能发生加成反应、氧化反应、取代反应、缩聚反应 |
| C、1mol该分子能与含2mol NaOH的溶液完全反应 |
| D、该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶解水垢(主要成分是碳酸钙)CaCO3+2H+→CO2↑+Ca2++H2O | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 :
: :
: :
: :
:查看答案和解析>>
科目:高中化学 来源: 题型:
 硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:
硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:| CaO或MgO |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和NOx反应的化学方程式为:2xCO+2NOx=2xCO2+N2 |
| B、上述方法的缺点是由于CO2增多,会大大提高空气的酸度 |
| C、多植树造林,增大绿化面积,可有效控制城市空气各种污染源 |
| D、汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com