
| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
分析 A.油脂是高级脂肪酸甘油酯;
B.油脂是高级脂肪酸与甘油形成的酯;
C.油脂中的碳链为碳碳单键时,即为饱和脂肪酸甘油酯;
D.过多食用油脂类物质,人体容易发胖.
解答 解:A.油脂在碱性条件下水解生成甘油和高级脂肪酸盐,故A正确;
B.油脂是高级脂肪酸与甘油形成的酯,在体内酶的催化作用下水解,生成相应的羧酸与甘油,故B正确;
C.油脂中的碳链为碳碳单键时,即为饱和脂肪酸甘油酯,主要是高沸点的动物脂肪,故C正确;
D.油脂是人体所需的基本营养物质之一,应适量摄入,过多食用油脂类物质,人体容易发胖,可能引发各种疾病,故D错误.
故选D.
点评 本题考查油脂的性质、组成与结构以及营养物质与人体健康的关系,要注意营养均衡,难度不大.


科目:高中化学 来源: 题型:选择题
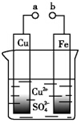
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的转化率为28.57% | B. | H2的转化率为85.7% | ||
| C. | N2的体积分数为20% | D. | H2的体积分数为10% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
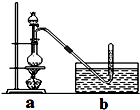 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠不慎着火,可用泡沫灭火器来灭火或湿布盖灭 | |
| B. | 往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 | |
| C. | 铝粉和MgO或Cr2O3粉末混合,高温能发生铝热反应 | |
| D. | 向紫色石蕊试液中加入Na2O2粉末,振荡后溶液变为蓝色并产生气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com