
| c3(C) |
| c(A)c2(B) |
| c3(C) |
| c(A)c2(B) |
| c3(C) |
| c(A)c2(B) |
| 1.03 |
| 2.0×2.02 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
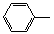 -CH=CH2)和D(HO-
-CH=CH2)和D(HO-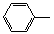 -CHO)按如下方法合成:
-CHO)按如下方法合成: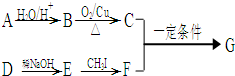
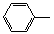 -ONa+RCH2I→
-ONa+RCH2I→ -OCH2R
-OCH2R| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )| A、X电极是阴极 |
| B、Y电极产生气体的体积为0.224L |
| C、电解后溶液的pH=1 |
| D、要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与Cl2燃烧反应 |
| B、Ba(OH)2?8H2O与NH4Cl反应 |
| C、灼热的炭与CO2反应 |
| D、氢氧化钠溶液与稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验步骤及现象 | |||||||
| A | 检验亚硫酸钠试样是否变质 | 试样
| ||||||
| B | 证明酸性条件下H2O2氧化性比I2强 | 碘化钠溶液
| ||||||
| C | 证明Cl2的漂白性 | MnO2和稀盐酸
| ||||||
| D | 探究浓度对于化学平衡的影响 | FeCl3和KSCN混合溶液
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com