
由烃类化合物A按下图关系可发生一系列变化:
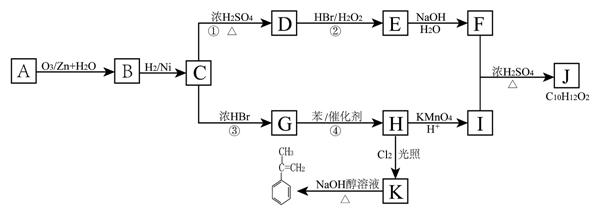
①F的核磁共振氢谱有4种峰。
②1molA完全反应可以生成2molB
③已知:  (其中R、R1、R2、R3和R4均表示烃基)
(其中R、R1、R2、R3和R4均表示烃基)
请回答下列问题:
(1)用系统命名法命名,A的名称为_____________,B中含有的官能团名称为 。
(2)指出反应的类型:①_________,②_________。
(3)有机物E和G之间的关系是_____________
(4)写出反应④的化学方程式_______________________________________。
(5)J的结构简式为 ,J有多种同分异构体,若J中苯环上只有两个取代基并处于间位, 1mol J能与2mol NaOH完全反应,写出满足上述要求的J的所有可能结构简式_________________________________。
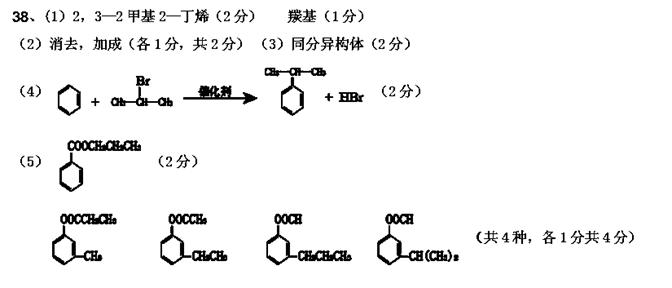
解析:由1molA完全反应可以生成2molB,说明A应为结构对称的烯烃,由于最终生成的J化学式已经知道,以及K发生消去反应后的产物已知可以知道,A应该为2,3—2甲基2—丁烯。所以生成的B为丙酮,C为2—丙醇。由C到D 是在浓硫酸加热条件下发生的消去反应,所以生成的D应该为丙烯,所以D到E的反应应该为在有过氧化物条件下发生的反马氏规则的加成反应,生成的E水解后得到1—丙醇。C到G的反应应该为醇与卤化氢的取代反应,所以得到的G为2—溴丙烷,G与苯在催化剂作用下发生亲电取代反应,生成异丙苯,异丙苯在酸性高锰酸钾作用下得到苯甲酸I,最终得到的J为苯甲酸1—丙酯。J的同分异构体要求要1mol能与2molNaOH反应,说明必修为酚酯,水解后得到酚和羧酸,所以其间位2取代物只有4种。分别为


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
下列ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是( )
A.20Ne和22Ne互为同位素 B.20Ne和22Ne互为同分异构体
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物的单体A(C11H12O2)可发生以下变化:
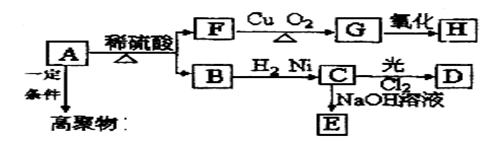
已知: C的烃基部分被取代生成的一氯代物D有两种;F的分子式为C7H8O,含有苯环,但与FeCl3溶液不显色。请回答:
(1)F分子中含有的官能团结构简式是 。
(2)由A生成B和F的反应类型为(选填序号)__ __。
①氧化反应 ②取代反应 ③水解反应 ④消去反应
(3)B的结构简式是____ 。
(4)分子式为C7H8O,含有苯环的同分异构体除F外还有__ __种。
(5)写出下列方程式
① 由A生成B和F ______ __;
② B → C ______ __;
③A在一定条件下生成高聚物 ______ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A、为防止富脂食品氧化变质可以在包装袋中加入生石灰
B、用医用酒精消毒是因为酒精可以使蛋白质发生盐析
C、绿色食品是不含任何化学物质的食品
D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来
查看答案和解析>>
科目:高中化学 来源: 题型:
由化合物A、M开始,可发生如图所示的变化。已知A由两种元素组成,且两元素的质量比为1:3 ,B、P、Y都是由短周期元素形成的简单氢化物,常温下Y为无色液体,B、P均为可燃性气体,M也是由两种短周期元素组成化合物,且M的焰色反应为黄色,C是一种不溶于水的白色固体,Q属于酸性氧化物。(框图中生成的水均已略去)
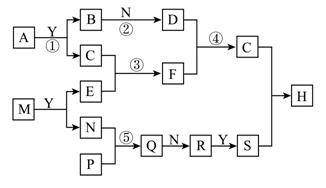
(1)A化学式为 。
(2)在25℃,101 kPa的条件下,若10g B在氧气中完全燃烧生成稳定氧化物所放出的热量为556.44 kJ,请写出表示C燃烧热的热化学方程式_____________________________。
(3)反应①的化学方程式为:_______________________________________________
(4)在反应①②③④⑤中属于氧化还原反应的是 。(填反应序号)
(5)对0.1mol/L 的F溶液进行检测,其溶液应呈 性(填“酸”或“碱”),用离子方程式解释溶液呈现此性质的原因 ,该溶液中各离子的浓度由大到小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol/L硫酸溶液的含义是
A.1L水中含有1molH2SO4 B.溶液中含有1molH2SO4
C.将98g浓硫酸溶于水配成1L溶液 D.指1L硫酸溶液中含有98gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
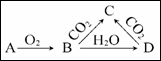
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则关于C的以下性质错误的是
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的 SO2 和 SO3 相比较,下列结论错误的是 ( )
A.它们的分子数目之比是 1∶1 B.它们的氧原子 数目之比为 2∶3
C.它们的质量之比为 1∶1 D.它们所含原子数目之比为 3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成 的化合物与G反应生成M。
的化合物与G反应生成M。
请回答下列问题:
⑴M固体的晶体类型是 。
⑵Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
⑶L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
⑷R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com