
对于实验甲~丁的实验现象预测正确的是( )

A.实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验乙:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验丙:从饱和食盐水中提取NaCl晶体
D.装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的组成性质分类及化学用语练习卷(解析版) 题型:选择题
将下列物质按酸、碱、盐分类依次排列正确的是( )
A.硫酸、纯碱、石灰石 B.氢硫酸、烧碱、绿矾
C.石炭酸、熟石膏、醋酸钠 D.磷酸、乙醇钠、苛性钾
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化工生产流程、无机物的判断练习卷(解析版) 题型:选择题
物质X、Y、Z均含有同一种元素,其转化关系如图所示。下列物质X和试剂M的组合不可能是( )

ABCD
X的化学式Na2OAlMgSO2
试剂M水NaOH溶液稀硫酸NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:选择题
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )

A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:选择题
用下列实验装置进行的实验中,能达到相应实验目的的是( )

A.装置甲:为防止铁钉生锈
B.装置乙:除去一氧化碳中混有的乙烯
C.装置丙:验证HCl气体在水中的溶解性
D.装置丁:实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:选择题
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
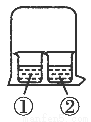
①中的物质②中的物质预测①中的现象
A淀粉-KI溶液浓溴水无明显变化
B石蕊溶液硫酸无明显变化
CAlCl3溶液浓氨水有白色沉淀
DAgNO3溶液浓盐酸有白色沉淀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本理论练习卷(解析版) 题型:选择题
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是( )
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
C.向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:填空题
化合物A、B是中学常见的物质,其阴阳离子只能从下表中选择:
阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为________________。
②A、B溶液混合加热反应的离子方程式为________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为____________________。
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示):
i________________________________;ii_______________________________,
③请用一简易方法证明上述溶液变黄的原因:________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b(a、b均为石墨电极),则b极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com