


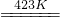 4KSbF6+2MnF3+F2
4KSbF6+2MnF3+F2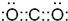 ,故答案为:
,故答案为: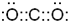 ;
; Fe+Al2O3,故答案为:Fe2O3+Al
Fe+Al2O3,故答案为:Fe2O3+Al Fe+Al2O3;
Fe+Al2O3; 2KF+H2↑+F2↑,故答案为:2KHF2
2KF+H2↑+F2↑,故答案为:2KHF2 2KF+H2↑+F2↑;
2KF+H2↑+F2↑;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解



| ||
| ||

| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省岱山大衢中学高一上学期期末考试化学试卷 题型:填空题
(10分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质
被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,反应①②均为工业上的重要反应。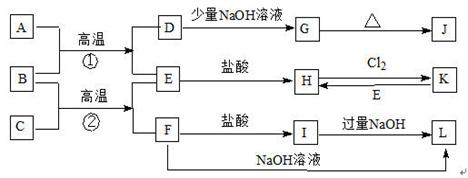
请回答下列问题:
(1)D是 ,K是 ;(填化学式)
(2)写出B与C高温反应生成E和F的化学方程式:
;
(3)写出D与J溶液反应生成G的离子方程式:
;
(4)写出图中I生成L的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次阶段性诊断考试化学试卷 题型:填空题
(12分)下图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下.A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。

请回答下列问题:
(1)写出下列物质的化学式:B______I______J______。
⑵在G、H、K的水溶液中,呈酸性的是______ (填化学式,下同);在C、D、L中.属于两性化合物的是____________。
(3)写出向K溶液中通人过量D时发生反应的离子方程式: ____________。
(4)写出向H溶液中通人SO2时发生反应的离子方程式: ____________。
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(一)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com